(本题共8分,(1)~(3)问1分/空,(4)问4分) 以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应过滤结晶
③ 为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 而除去。
(2)①中加入的试剂应该选择_________为宜,其原因是________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________________。
(4)下列与方案③相关的叙述中,正确的是__________________(填字母每填对一个给1分但每错一个在本问内倒扣1分)。
A H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B 将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C 调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
(8分)已知溶液中:还原性HSO3->I-,氧化性IO >I2>SO42-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
>I2>SO42-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。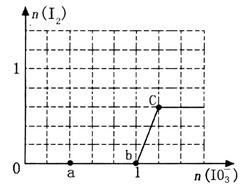
试回答下列问题:
(1)写出a点反应的离子方程式____________;反应中还原剂是_______;被还原的元素是________。
(2)写出b点到c点反应的离子方程式_______________。
(3)若往100mL 1 mol·L-1的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为__________。
(9分)五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)D元素在周期表中的位置是____________。
(2)B、C、D元素原子半径由大到小的顺序是__________(用元素符号表示)。
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为_________。
(4)单质E与水反应的离子方程式为____________。
(5)下列选项中能作为判断B和D的非金属性强弱的依据有(填字母编号)_______。
a.B和D的单质的熔点高低
b.B和D的氢化物的稳定性强弱
c.B和D的单质与氧气反应的难易
d.B和D的最高价氧化物对应的水化物的酸性强弱
Ⅰ.向FeCl3溶液中加入铁粉和铜粉混合粉末,充分反应后,下列情况可能存在的是(填序号)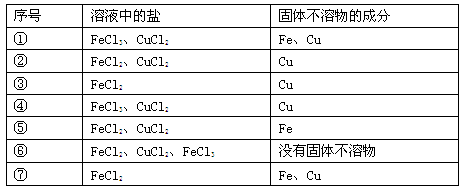
Ⅱ.今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3,溶液(其他用品略),某课外活动小组同学的实验结果如下(假定反应前后溶液体积不变)。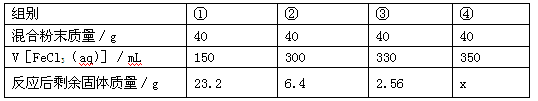
(1)试判断第④组剩余固体质量x为。第①组实验中,发生反应的离子方程式为。
(2)试判断第②组剩余固体的成分为。
(3)原混合粉末中Fe、Cu的物质的量之比为。
(9分)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。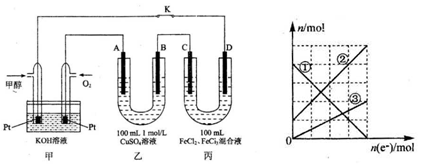
Ⅰ.工作一段时间后,断开K,此时 C电极质量减少3.2g。
(1)甲中负极的电极反应式为
(2)乙溶液此时离子浓度由大到小的顺序是
Ⅱ.连接K,继续电解一段时间,当A,B两极上产生的气体体积相同时
(3)乙中A极析出的气体在标准状况下的体积为,溶质的物质的量浓度为mol/L (不考虑溶液体积变化)
(4)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是离子的变化;此时要使丙装置中金属阳离子恰好完全沉淀,需要mL 5. 0 moL/L NaOH 溶液。
(8分)氧化还原反应实际上包含氧化反应和还原反应两个过程,一个还原反应过程的离子方程式为:NO+4H++3e-===NO↑+2H2O。下列四种物质:KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质甲,滴加少量稀硝酸,能使上述反应过程发生。
(1)被还原的元素是________;还原剂是________。
(2)写出并配平该氧化还原反应方程式:________________________________________。
(3)反应生成0.3 mol H2O,则转移电子的数目为____________。
(4)若反应后,氧化产物的化合价升高,而其他物质保持不变,则反应中氧化剂与还原剂的物质的量之比将________(填“增大”、“不变”、“减小”或“不能确定”)。