(本题共4分,1分/空)如下图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间。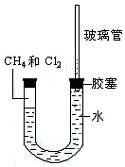
(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学
方程式 。
(2)经过几个小时的反应后,U型管右端的玻璃管中水柱变化是 。
A.升高 B.降低 C.不变 D.无法确定
(3)U型管左端的气柱变化是 。
A.体积增大 B.体积减小 C.消失 D.不变
(4)试解释U型管右端的玻璃管中水柱变化的原因:____________。
(1)室温时氢氧化钙的溶度积Ksp=4.7×10-6,室温时将9mL 0.02mol·L-1的氯化钙溶液与1mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中
沉淀析出(填有或无)。
(2)2 .24升(标准状态)氨气通入250mL浓度为0.1mol·L-1的硫酸溶液中,充分反应后溶液中各离子浓度由大到小的顺序为 。
.24升(标准状态)氨气通入250mL浓度为0.1mol·L-1的硫酸溶液中,充分反应后溶液中各离子浓度由大到小的顺序为 。
(3)用下图完成相应实验。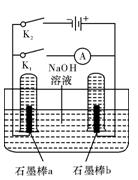
①断开K1,闭合K2接通直流电源,写出阳极的电极反应式 ;
②电解一段时间后,当两石墨棒均有气体包围时,切断K2闭合K1,发现电 路中有电流通过。写出a极的电极反应式 。
路中有电流通过。写出a极的电极反应式 。
H2还原CuO所得的红色固体可能是Cu与Cu2O的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。现有8g CuO被H2还原后,得到红色固体6.8g。
(1)6.8 g上述混合物中含Cu与Cu2O的物质的量之比是;
(2)若将6.8 g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体g;
(3)若将6.8 g上述混合物与一定量的浓硝酸充分反应,生成标准状况下1.568 L的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是,其物质的量之比是;
某有机化合物A的结构简式如图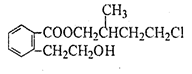 ,回答下列问题:
,回答下列问题:
(1)A的分子式为。
(2)A在NaOH水溶液中加热得到B和C,C是芳香族化合物,则C的结构简式是。
(3)B与足量的某饱和一元羧酸D充分反应后生成E,E和B的相对分子质量之差为84,则D的摩尔质量为。
(4)C酸化后可得F,F不能发生的反应类型是(填写字母代号) 。
。
a.取代反应 b.加成反应 c.消去反应 d.加聚反应
e.氧化反应 f.还原反应
(5)F可以发生如下转化,且G与H互为同分异构体。
请写出:①H的结构简式。
②由F生成G的化学方程式。
(6)符合下列三个条件的F的同分异构体的数目有个。
①含有邻二取代苯环结构;②与F具有相同的官能团;③不与FeCl3溶液发生显色反应。
甲、乙、丙、丁为前三周期元素形成的微粒,它 们的电子总数均为14。
们的电子总数均为14。
已知:甲为原子;乙、丙、丁为双 原子分子或离子。
原子分子或离子。
⑴甲单质与氢氧化钠溶液反应的离子方程式为 ;
⑵乙是双原子分子,在高温时是一种还原剂。14 g乙燃烧放出的热量是141.5 kJ。写出乙燃烧的热化学方程式。
⑶丙为双原子二价阴离子,与钙离子组成的化合物能跟水反应产生一种可燃性气体。该可燃性气体能与乙酸在一定条件下,按物质的量比1∶1发生加成反应生成一种酯,该化学方程式是为。
⑷由丁分子组成的物质属于单质,组成丁的元素最高价氧化物对应的水化物X有下图所示转化关系(反应条件和其他物质已略)
已知W为金属单质,W在周期表中的位置 。
写出X的稀溶液与Z反应的离子方程式:。
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Na+、Al3+、Ba2+、NH4+ |
| 阴离子 |
Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
① A、D溶液呈碱性,B呈酸性,C呈中性
② A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③ A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝
回答下列问题:
( 1)A的化学式是,用电子式表示C的形成过程:。
1)A的化学式是,用电子式表示C的形成过程:。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:
(3)写出③的离子方程式
(4)简述D溶液呈碱性的理由