(选修5-有机化学基础)高分子材料M在光聚合物和金属涂料方面有重要用途,M的结构简式为: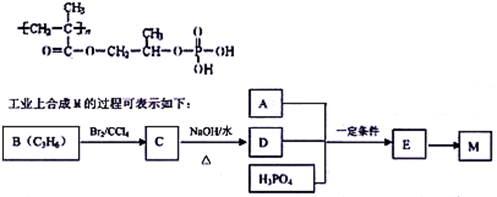
已知:A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,分子中H、O原子个数比为3︰1。它与Na或Na2CO3都能反应产生无色气体。请回答下列问题:
(1)A中含有的官能团的名称是 。
(2)下列说法正确的是 (填序号字母)。
a.工业上,B主要通过石油分馏获得
b.C的同分异构体有2种(不包括C)
c.D在水中的溶解性很大,遇新制Cu(OH)2悬浊液,溶液呈绛蓝色
d.E—M的反应是缩聚反应
(3)写出A+D+H3PO4→E反应的化学方程式: ;该反应类型是 。
(4)F是A的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子。存在下列转化关系:
写出F、N的结构简式为:F: ;N: ;
写出反应①的化学方程式 。
回答下列问题:
① CH2=CH-CH=CH2 键线式__________②羟基(-OH)的电子式_____________
③ 的结构简式___________④芳香烃萘
的结构简式___________④芳香烃萘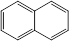 的分子式为
的分子式为
质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是_,含有原子数目最多的是,在相同温度和相同压强条件下,体积最大的是。
为了除去NaCl溶液中少量的MgCl2、Na2SO4,从稀盐酸,Na2CO3,K2CO3,Ba(NO3)2,Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中步骤进行操作:
(1)下列试剂的化学式AC
(2)加入过量A的原因是,有关反应的离子方程式是,
(3)加入过量B有关反应的离子方程式是。
按要求写出下列化学反应的方程式:
(1)写出下列化学反应的离子方程式:
①将CO2通入过量的澄清石灰水中,
②将CuO粉末投入稀硫酸中,
(2)写下列离子方程式对应的化学反应的化学方程式:
2H++CO32- = CO2↑+H2O 。
有以下几种物质:①熔融态的食盐晶体②液态氯化氢③银④蔗糖⑤干燥的Na2CO3晶体⑥酒精⑦CO2⑧NaOH溶液,填空回答:(填序号)
(1)以上物质能导电的是,
(2)以上物质中属于电解质的是,
(3)以上物质属于非电解质的是。