PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl2(g)  PCl5(g)。有关数据如下:
PCl5(g)。有关数据如下:
| |
PCl3(g) |
Cl2(g) |
PCl5(g) |
| 初始浓度/(mol/L) |
2.0 |
1.0 |
0 |
| 平衡浓度/(mol/L) |
c1 |
c2 |
0.4 |
下列判断不正确的是( )
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时, c(PCl5)<0.2 mol/L
体积可变容器中,可逆反应A(g)+2B(g) nC(g)(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是:
nC(g)(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是:
| A.p2>p1,n<3 | B.p2>p1,n>3 |
| C.p1>p2,n<3 | D.p1>p2,n>3 |
在t1℃时2A(气) 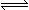 B(气) △H=Q达到平衡时混合气体的平均分子量为M1, t2℃时该反应的平衡混合气体的平均分子量为M2 , 当平衡从t1℃升温至t2℃时,下列说法中正确的是:
B(气) △H=Q达到平衡时混合气体的平均分子量为M1, t2℃时该反应的平衡混合气体的平均分子量为M2 , 当平衡从t1℃升温至t2℃时,下列说法中正确的是:
| A.若Q<0,平衡左移,M1>M2 | B.若Q<0,平衡右移, M1<M2 |
| C.若Q>0,平衡左移,M1>M2 | D.若Q>0,平衡右移, M1<M2 |
在密闭容器中加入4mol A和2mol B发生如下反应2A(气)+B(气)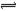 3C(气)+D(气)达到平衡时,C的浓度为p mol/L,若温度和体积不变时按下列配比作为起始物质,达到平衡后C浓度仍为p mol/L的是:
3C(气)+D(气)达到平衡时,C的浓度为p mol/L,若温度和体积不变时按下列配比作为起始物质,达到平衡后C浓度仍为p mol/L的是:
| A. 2molA+1molB | B. 2molA+1molB+3molC +1moD |
| C. 3molC+1molD | D. 6molC+2molD |
已知N2+3H2=2NH3 △H<0,硫化氢难电离。下列事实不能用勒夏特列原理解释的是:
| A.给硫化氢水溶液中加碱有利于S2-的生成 |
| B.加入催化剂有利于氨的氧化反应 |
| C.高压有利于合成氨反应 |
| D.500℃左右比室温更利于合成氨的反应 |
在一定温度下,反应A2(气)+ B2(气) 2AB(气)达到平衡的标志是:
2AB(气)达到平衡的标志是:
| A.单位时间生成的n mol的A2同时生成2n mol的AB |
| B.容器内的总压强不随时间变化 |
| C.单位时间生成2n mol的AB同时生成n mol的B2 |
D.单位时间生成 n mol的A2同时生成n mol的B2 n mol的A2同时生成n mol的B2 |