(15分)下图是一种治疗关节炎止痛药(F)的传统合成法路线图: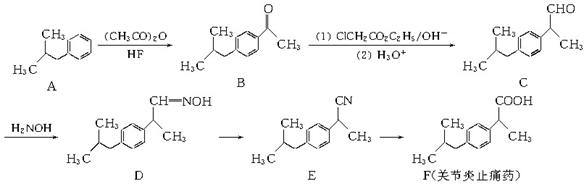
回答下列问题:
(1) A→B的化学方程式为________________。
(2) C分子中手性碳原子数目为________;D→E的反应类型为________。
(3) E在酸性条件下发生水解反应生成F和无机盐,该无机盐中的阳离子为________。
(4) 比F少5个碳原子的同系物X有多种同分异构体,其中满足下列条件的X的同分异构体结构简式为(写出任意一种)________。
① 属于芳香族化合物;② 苯环上只有1个取代基;③ 属于酯类物质。
(5)改良法合成该关节炎止痛药(F)是以2甲基-1-丙醇、苯为原料合成的,产率和原子利用率都比较高。试写出改良法合成该关节炎止痛药(F)的合成路线图(乙酸酐和其他无机试剂任选)。合成路线流程图示例如下:
CH3CH2OH CH2==CH2
CH2==CH2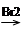 BrCH2CH2Br
BrCH2CH2Br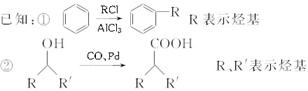
2014年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
①该反应的ΔH 0(填“>”“<”)。
②在T2温度下,0~2 s内的平均反应速率v(N2)= 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)已知:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)ΔH1
2CO(g)+O2(g)===2CO2(g)ΔH2
2H2(g)+O2(g)===2H2O(g)ΔH3
则反应CO(g)+2H2(g)===CH3OH(g)的ΔH=___ 。
(3)某实验小组用50mL 0.50mol·L- 1 NaOH 溶液和30mL 0.50mol·L- 1硫酸溶液进行中和热的测定。实验数值结果比57.3 kJ/mol偏小,产生此实验偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
25 ℃时,电离平衡常数:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
|
| 电离平衡常数 |
1.8×10-5 |
K1 4.3×10-7 K2 5.6×10-11 |
3.0×10-8 |
|
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是_____________;(填编号)
a.CO32-b.ClO-c.CH3COO-d.HCO3-
(2)下列反应不能发生的是: ;
a.CO32- + CH3COOH=CH3COO- + CO2 ↑ + H2O
b.ClO- + CH3COOH=CH3COO- + HClO
c.CO32- + HClO=CO2 ↑+ H2O + ClO-
d.2 ClO- + CO2 + H2O=CO32-+ 2 HclO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是_________;
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
(5)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。计算:
①原混合溶液中c(H+)=___________________;c(Cl-)=_________________。
②A点的pH=_________________。
③将0.15 mol·L-1稀硫酸V1mL与0.1 mol·L-1NaOH溶液V2mL混合,所得溶液pH为1,则V1∶V2=
(溶液体积变化忽略不计)。
工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:(已知:NaCl熔点为801℃;AlCl3在181℃升华)
(1)钢材镀铝后,抗腐蚀性能会大大增强,其原因是 。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有 ,固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 _。
(3)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 。
(4)向滤液中通入过量CO2所发生反应的离子方程式为 。
(5)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_ 。
[化学-选修5:有机化学基础]
有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个—CH3,且它们的核磁共振氢谱中均出现4个峰。
请回答:
(1)B中所含官能团的名称为 ; D的分子式为 ;
(2)Ⅲ的反应类型为 (填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(3)写出下列反应的化学方程式:
a.反应Ⅰ: ;
b.A在催化剂条件下,反应生成高聚物: ;
(4)A分子中最多有 个原子共平面,A的同分异构体中有一对互为顺反异构的链状有机物,且结构中含有2个—CH3,它们的结构简式为 和 ;
(5)E的一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为 。
对下列物质选择合适的试剂和除杂方式(括号内为杂质)
| 物质(杂质) |
试剂 |
提存方法 |
| 己烷(己烯) |
||
| 溴苯(溴) |
||
| 乙醇(乙酸) |
||
| 乙酸乙酯(乙醇、乙酸) |