X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
③Z+与Y 2-具有相同的电子层结构;
请回答:
(1)Z2Y2的电子式为 ,含有的化学键类型为 ,Z2Y2为 晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为 ;XY2的结构式为 ,分子的立体构型为 。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是 (填名称);晶体ZW的熔点比晶体XW4明显高的原因是 。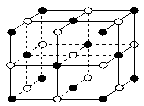
(4)ZW晶体的结构示意图如图。已知:ZW晶体的密度为ρ,摩尔质量为M,阿伏伽德罗常数为NA,则ZW晶体中两个最近的Z离子中心间的距离d可以表示为d= 。
能源的开发利用与人类社会的可持续性发展息息相关。
I.已知:Fe2O3(s)+3C(s)= 2Fe(s)+3CO(g) △H1="a" kJ·mol-1
CO(g)+ O2(g)=CO2(g) △H2="b" kJ·mol-1
O2(g)=CO2(g) △H2="b" kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) △H3="c" kJ·mol-1
则C的燃烧热________kJ·mol-1
II.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是____(填序号)。
A.C(s)+CO2(g)=2CO(g)B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)
C.2H2O(l) = 2H2(g)+O2(g)D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:___________。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中 与时间t的关系如图所示。
与时间t的关系如图所示。
请回答下列问题:
①反应达平衡的标志是(填字母代号)________。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以c(N2)变化表示的平均反应速率为________。
③若提高N2的转化率可采取的措施有________。
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大
E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO32-)=0.2mol·L-1,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol • L-1。
芳香烃A是一种重要的存机化工原料,相对分子质量为92。A在一定条件下可发生如下转化(部分产物及反应条件略去)。
已知:
请回答:
(1)A的化学名称为_______G的结构简式为______。
(2)B的核磁共振氢谱有______个吸收峰,③的反应类型为______。
(3)⑤的化学方程式为,
阿司匹林与足量氢氧化钠溶液反应的化学方程式为。
(4)符合下列条件的E的同分异构体共有种,任写出其中一种的结构简式。
i.能发生银镜反应但不能水解
ii.1 mol同分异构体最多消粍2 mol NaOH
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)砷的基态原子的电子排布式为。
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主。Ga和As相比,电负性较大的是,GaAs中Ga的化合价为。
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为;
AsH3的沸点高于PH3,其主要原因为。
(4)Na3AsO4可作杀虫剂。AsO43-的立体构型为,与其互为等电子体的分子的化学式为(任写一种)。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因。
(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图。已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为______g/cm3(只要求列算式,不必计算)。
硫酸铅(PbSO4)广泛应用于制造蓄电池、白色颜料等。利用锌冶炼过程中的铅浮渣生产PbSO4的流程如下:
已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,Ksp(CaSO4)=4.9x10-5,Ksp(PbSO4)=1.6xl0-8。
(1)已知步骤I有NO气体产生,浸出液中含量最多的阳离子是Pb2+。分别写出PbO、Pb参加反应的化学方程式。
(2)步骤I需控制硝酸的用量并使Pb稍有剩佘,目的是。
(3)母液可循环利用于步骤I,其溶质主要是(填一种物质化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是。
(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为。
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1))重晶石(BaS04)常作胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时, 溶液中 c(Ba2+)=。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H20]常作分析剂。
①检验晶体中含有NH4+的方法为_______。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2b.NH4HSO4c.(NH4)2SO4d.(NH4)2SO3
其中C(NH4+)由大到小的顺序为(填选项字母)。
(3)过二硫酸钾(K2S2O8)常作强氧化剂,Na2S2O3常作还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色, 该反应的离子方程式为
②用铂作电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为_______电解过程中阴极附近溶液的pH将______ (填“增大”、“减小”或“不变”)
③产品中K2S2O8的含量可用碘量法测定。操作步骤为:称取0.3g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以______为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00mL。该产品中K2S2O8的质量分数为(杂质不参加反应)(列式并计算)。