氮化硼是一种新合成的结构材料,它是超硬、耐磨,耐高温的物质,下列各组物质熔化时所克服的粒子间的作用与氮化硼熔化时所克服的粒子间作用相同的是
| A.C60和金刚石 | B.晶体硅和水晶 | C.冰和干冰 | D.碘和金刚砂 |
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是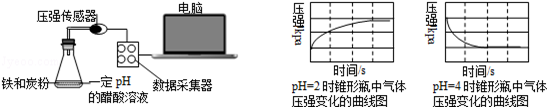
| A.溶液pH≤2时,生铁发生析氢腐蚀 |
| B.在酸性溶液中生铁可能发生吸氧腐蚀 |
| C.析氢腐蚀和吸氧腐蚀的速率一样快 |
| D.两溶液中负极反应均为:Fe﹣2e﹣=Fe2+ |
如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实验图示转化关系的是
| 选项 |
W |
X |
Y |
Z |
 |
| A |
S |
SO2 |
SO3 |
H2SO4 |
|
| B |
Na |
Na2O2 |
NaOH |
NaCl |
|
| C |
Al |
AlCl3 |
NaAlO2 |
Al2(SO4)3 |
|
| D |
Fe |
FeCl3 |
Fe(OH)2 |
FeCl2 |
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,Y原子的核外电子数是内层电子的4倍,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
| A.元素Q的最高价氧化物对应的水化物酸性比W的强 |
| B.化合物W2Q2中,各原子最外层均达8电子结构 |
| C.工业上通过电解Z与Q形成的化合物制备Z单质 |
| D.Y单质与X的气态氢化物可发生置换反应 |
下表中“实验操作”与“预期现象”对应关系正确的是
| 选项 |
试剂和操作 |
现象 |
| A |
向AlCl3溶液中滴入过量的氨水 |
溶液先有白色沉淀,后来沉淀消失 |
| B |
向新生成的AgC1浊液中滴入KI溶液,振荡 |
白色沉淀逐渐转化为黄色沉淀 |
| C |
向Ca(C1O)2溶液中先通入CO2,再加入少量品红溶液 |
溶液先变浑浊,通入CO2后品红的红色不褪去 |
| D |
向BaC12溶液中先通入SO2,再通入过量NO2 |
先生成沉淀,后来沉淀消失 |
稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+.下列说法正确的是
A. 它们互称为同素异形体 它们互称为同素异形体 |
| B.铈溶于氢碘酸的主要化学方程式可表示为:2Ce+6HI═2CeI3+3H2↑ |
| C.工业上可以采用电解氯化铈水溶液来获得铈单质 |
| D.工业上金属铈一般保存在敞口容器中 |