在一定温度下,反应:2A(s)+2B(g)  C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
| A.混合气的密度不再随时间而变化 | B.C的质量不再改变 |
| C.容器内的压强不随时间而变化 | D.单位时间内生成2a mol B,同时生成a molD |
取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量间的关系如图所示,下列有关说法正确的是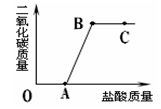
| A.OA段没有发生任何反应 |
| B.C点的溶液的pH=7 |
| C.B点表示加入的盐酸与原溶液中的溶质恰好完全反应 |
| D.C点溶液中的溶质只有NaCl |
下表中除杂方法正确的是
| 选项 |
物质 |
所含杂质 |
除去杂质的方法 |
| A. |
CO |
CO2 |
通过足量氢氧化钠溶液,并干燥 |
| B. |
H2 |
水蒸气 |
通过盛有浓硫酸的洗气瓶 |
| C. |
N2 |
O2 |
通过炽热的木炭 |
| D. |
NaOH溶液 |
Na2CO3 |
加入足量稀盐酸至不再产生气泡 |
某气体由氢气、一氧化碳、甲烷中的一种或几种组成。点燃该气体后,在火焰上方罩一冷而干燥的烧杯,烧杯内壁出现水雾;把烧杯迅速倒转过来,注入少量澄清石灰水,振荡,石灰水变混浊。下列对气体组成的推断不正确的是
| A.可能三种气体都存在 | B.可能只有氢气 |
| C.可能是甲烷和一氧化碳的混合气体 | D.可能只有甲烷 |
下列试剂中,能把NaOH溶液、稀硫酸、CaCl2溶液一次鉴别出来的是
| A.NaCl | B.稀盐酸 | C.NaNO3溶液 | D.Na2CO3溶液 |
下列各组物质能按照关系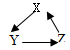 转化,都能一步完成的是
转化,都能一步完成的是
| A |
B |
C |
D |
|
| X |
C |
Na2O |
CaO |
Fe |
| Y |
CO2 |
NaOH |
CaCl2 |
Fe2O3 |
| Z |
Na2CO3 |
NaCl |
CaCO3 |
Fe(OH)3 |