铀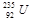 是重要的核工业原料,在自然界中的含量很低。下列有关铀
是重要的核工业原料,在自然界中的含量很低。下列有关铀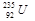 的说法正确的是
的说法正确的是
A.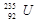 与 与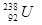 的性质完全相同 的性质完全相同 |
B.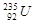 原子核中含有143个中子 原子核中含有143个中子 |
C.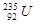 属于短周期元素 属于短周期元素 |
D.1mol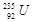 的质量是143g 的质量是143g |
下列物质中既有离子键又有共价键的是
| A.NaCl | B.H2O2 | C.KOH | D.H2S |
下列有关化学反应速率及限度的描述错误的是
A.催化剂能改变化学反应的速率 |
B.一定条件下的可逆反应,反应物的转化率不可能达到100% |
C.有气体参加的反应,通过压缩体积增大压强,可以使反应速率增大 |
D.当化学反应达到其最大限度时,反应就停止了 |
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列结论正确的是
| A.相同温度下,x的电离平衡常数小于y |
| B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大 |
| C.若x、y都是弱碱,则a的值一定大于9 |
| D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
| A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小 |
| B.三个不同温度中,313K时Ksp(SrSO4)最大 |
| C.283K时,图中a点对应的溶液是饱和溶液 |
| D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |