某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定)有剩余气体。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
①粉末中一定有Na2O、Na2O2、NaHCO3
②粉末中一定不含有Na2CO3和NaCl
③粉末中一定不含有Na2O和NaCl
④无法肯定粉末中是否含有Na2CO3和NaCl
| A.①② | B.②③ | C.③④ | D.①④ |
可逆反应2NO2 2NO+O2在体积不变的密闭容器中进行,下列能说明该反应达到最大限度的是 ①单位时间内生成n mol O2的同时生成2n molNO②单位时间内生成n mol O2的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态()
2NO+O2在体积不变的密闭容器中进行,下列能说明该反应达到最大限度的是 ①单位时间内生成n mol O2的同时生成2n molNO②单位时间内生成n mol O2的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态()
| A.①④ | B.②④ | C.①③④ | D.②③④⑤ |
有关元素的叙述正确的是:
| A.金属元素与非金属元素能形成共价化合物 |
| B.只有在原子中,质子数才与核外电子数相等 |
| C.完全由非金属元素形成的化合物中不含离子键 |
| D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
下列反应中,属于氧化还原反应同时又是吸热反应的是
| A.Ba(OH)2·8H2O与NH4Cl反应 | B.铝与稀盐酸 |
| C.灼热的炭与CO2反应 | D.甲烷与O2的燃烧反应 |
下列各组物质性质的比较,正确的是( )
| A.酸性:HClO4>H3PO4>H2SO4 | B.碱性:KOH>NaOH>Mg(OH)2 |
| C.离子半径:O2->F->Cl->Na+ | D.氢化物稳定性:H2S>HF>H2O |
阴离子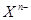 含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是
含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是
A. mol mol |
B. mol mol |
C.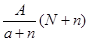 mol mol |
D. mol mol |