为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是
| |
实验操作 |
实验现象 |
离子反应 |
实验结论 |
| A |
在氯化亚铁溶液中滴加新制氯水 |
浅绿色溶液变成棕黄色溶液 |
2Fe2++Cl2=== 2Fe3++2Cl- |
Fe2+具有还原性 |
| B |
在氯化亚铁溶液中加入锌片 |
浅绿色溶液变成无色溶液 |
Fe2++Zn=== Fe+Zn2+ |
Zn具有还原性 |
| C |
在氯化铁溶液中加入铁粉 |
棕黄色溶液变成浅绿色溶液 |
Fe3++Fe=== 2Fe2+ |
铁单质具有还原性 |
| D |
在氯化铁溶液中加入铜粉 |
蓝色溶液变成棕黄色溶液 |
2Fe3++Cu=== 2Fe2++Cu2+ |
Fe3+具有氧化性 |
镁铝合金5.4g溶于过量的热浓硝酸中,反应产生11.2 LNO2(标准状况),若在反应后溶液中加入过量的氢氧化钠溶液,则生成沉淀质量为
| A.4.5g | B.6 g | C.8.7g | D.13.9g |
下列离子方程式正确的是
A.向NH4HCO3溶液中加过量NaOH溶液并加热: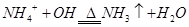 |
B.用KIO3氧化酸性溶液的KI: == ==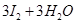 |
C.向Ba(OH)2溶液中滴加稀硫酸: == ==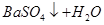 |
D.用稀硝酸洗涤试管内壁的银镜: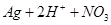 == == |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法正确的是
| A.原子半径Z>Y |
| B.X的最简单气态氢化物的热稳定性比Z的强 |
| C.M与Z形成的化合物中只存在离子键 |
| D.M的最高价氧化物对应水化物不能与NaOH溶液反应 |
化学与能源开发、环境保护、生产生活等密切相关。下列叙述错误的是
| A.光催化水制氢比电解水制氢更节能环保 |
| B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染 |
| C.开发利用可再生能源,可减少化石燃料的使用 |
| D.改进汽车尾气净化技术,可减少大气污染物的排放 |
下列叙述正确的是
| A.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| B.常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小 |
| C.在0.1 mol·L-1 CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+) |
| D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) |