如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。填写下列空白: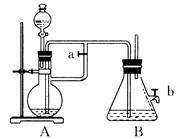
(1)B中盛有 溶液,A中应预先加入的药品是________,A中反应的离子方程式是:_________________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程________。这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是___________________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生反应的化学方程式为:____________________。现象
(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如下图。由图中可以看出,该同学在操作时的一个错误是____________________,烧杯的实际质量为_______________g。
(2)指出下面实验中各存在的两个错误:
A.需配制150 mL 0.2 mol·L-1NaCl溶液,右图是该同学转移溶液的示意图。
_______________________________________________________________________。
B.除去氯气中的氯化氢气体:
_______________________________________________________________________。
(3)用98%密度为1.84 g·cm-3的浓硫酸配制1 000 mL 0.1 mol·L-1稀硫酸。
①应用量筒量取浓硫酸___________________mL。
②配制硫酸溶液时需要用到的仪器有________________。(除量筒外,写出其余四种)
③下列操作结果,所配溶液物质的量浓度偏低的是________________。
A.没有将洗涤液转移到容量瓶中
B.容量瓶洗净后未经干燥处理
C.定容时仰视观察液面
D.摇匀后立即观察,发现溶液未达刻度线,再用滴管加几滴蒸馏水至刻度线
(11分)某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有________(填代号,限填3项)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是________________________。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用________(填代号)。
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2
理由是__________________________________。
(4)第4步:碘单质的检验。操作是____________________________。
(12分)从某物质A的水溶液出发有如图所示的转化关系:
回答下列问题:
(1)写出C、D、E的化学式:C________,D________,E________。
(2)检验B溶液中阴离子的实验操作和实验现象是
________________________________________________________________________。
(3)写出下列反应的离子方程式:
①A+足量NaOH溶液
________________________________________________________________________。
②C、D按体积比1∶1通入水中
________________________________________________________________________。
③A+H2O2―→________________________________________。
(12分)下列是治疗口腔炎症的药物华素片(西地碘片)的部分使用说明:
| 使用说明书 |
|
| 主要成分 |
活性分子碘(I2),含量1.5 mg/片 |
| 贮藏 |
遮光、密闭、在阴凉处保存 |
| 有效期 |
二年 |
请根据上述说明回答:
(1)推断华素片________(填“是”或“不是”)白色。
(2)某同学欲证实该药片中确实含有分子碘,设计并完成如下实验:
①将药片研碎、溶解、过滤,所得滤液分装于甲、乙两试管中备用。
②在甲试管中加入下列一种试剂,振荡、静置,观察到液体分层,若上层液体颜色为________色,则所加试剂为下列中的________,由此说明存在分子碘。
A.苯
B.酒精
C.四氯化碳
D.盐酸
③在乙试管中滴加________溶液,溶液变蓝色,也能说明存在分子碘。
(3)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在。几种粒子之间有如下转化关系:
①如以途径Ⅰ制取I2,加的Cl2要适量,如过量就会发生途径Ⅲ的副反应,在该副反应的产物中,IO与Cl-物质的量之比为1∶6,则氧化剂和还原剂物质的量之比为________。
②已知IO在通常情况下是比较稳定的,而在酸性溶液中则具有较强的氧化性。下列离子在酸性条件下可被其氧化的有________(多选倒扣分)。
A.Fe3+ B.F- C.ClO D.I-
(12分)(1)请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸四种酸氧化性相对强弱的实验中发生的有关问题:
分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸;②稀硫酸;③浓硝酸;④稀硝酸,能随即发生反应的是(填序号,下同)________,微热则发生反应的是________,加热后发生反应的是________,加热也不发生反应的是________。由此可以得到上述四种酸氧化性由强到弱的顺序是________。
(2)盐酸、硫酸是中学阶段常见的酸。请就其与金属铜反应的情况,回答下列问题:
①我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为
________________________________________________________________________。
②在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9 mol,则该硫酸的实际体积________(填“大于”“等于”或“小于”)100 mL。有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?________(填“可行”或“不可行”)。