某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。 向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐 加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )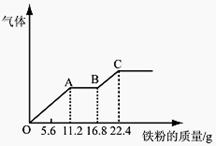
| A.原混合酸中NO3-物质的量浓度为2 mol/L |
| B.OA段产生的是NO,AB段的反应为 Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol·L-1 |
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液 中通入氯气,使溶液中Cl- 和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为()(还
中通入氯气,使溶液中Cl- 和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为()(还 原性I->Fe2+>Br->Cl-)
原性I->Fe2+>Br->Cl-)
| A.7∶1 | B.7∶3 | C.7∶2 | D.7∶4 |
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液② 加入稍过量的NaOH溶液③ 加入稍过量的BaCl2溶液④滴入稀盐酸至无气泡产生⑤ 过滤。正确的操作顺序是()。
| A.③②①⑤④ | B.①②③⑤④ | C.②③①④⑤ | D.③⑤②①④ |
 g某元素(无同位素)所含原子数目为
g某元素(无同位素)所含原子数目为 ,该元素原子的摩尔质量为
,该元素原子的摩尔质量为 g/mol ,则氯元素的一种同位素
g/mol ,则氯元素的一种同位素 的一个原子的质量是( )(注:该Cl原子的相对原子质量≈35)
的一个原子的质量是( )(注:该Cl原子的相对原子质量≈35)
A. g g |
B. g g |
C. g g |
D. g g |
下列除去杂质的方法正确的是()
| A.除去CO2中的少量SO2:先将气体通入饱和Na2CO3溶液,再收集剩余气体 |
| B.除去NaHCO3溶液中混有的少量Na2CO3(Na2CO3摩尔质量较大):通过蒸馏,收集蒸馏产物 |
| C.除去FeCl3溶液中混有的少量AlCl3溶液:加入足量的NaOH溶液,充分反应后,过滤,向沉淀中加盐酸使其恰好完全溶解 |
D.除去碘水中的I2:加 入乙醇进行多次萃取,留在分液漏斗中的即为较纯净的水 入乙醇进行多次萃取,留在分液漏斗中的即为较纯净的水 |
按照物质的树状分类和交叉分类,HNO3应该属于()
①酸②氢化物③氧化物④含氧酸⑤难挥发性酸⑥强氧化性酸⑦一元酸⑧化合物⑨混合物
| A.①②③④⑤⑥⑦⑧ | B.①④⑤⑥⑦⑨ | C.①⑨ | D.①④⑥⑦⑧ |