下列实验设计能够成功的是( )
| |
实验目的 |
实 验 步 骤 及 现 象 |
| A |
检验亚硫酸钠试 样是否变质 |
 |
| B |
检验某盐是否为铵盐 |
 |
| C |
证明酸性条件 H2O2氧化性比I2强 |
 |
| D |
除去氯化钠晶体中少量硝酸钾 |
 |
下列实验不合理的是
| A.证明非金属性强弱 S>C>Si | B.四氯化碳萃取碘水中的碘 |
| C.制备并收集少量NO气体 | D.制备少量氧气 |
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br-一定被氧化;②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;③不能确定通入氯气后的溶液中是否存在Fe2+;④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
| A.①②③ | B.②③④ | C.①③④ | D.①②③④ |
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗 x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)为
| A.(y-2x)/a mol/L | B.(y-x)/a mol/L |
| C.(2y-2x)/a mol/L | D.(2y-4x)/a mol/L |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: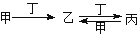 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
| A.若甲为焦炭,则丁可能是O2 |
| B.若甲为AlCl3,则丁可能是NaOH |
| C.若甲为Fe,则丁可能是氯气 |
| D.若甲为NaOH 溶液,则丁可能是CO2 |
下列实验过程中产生沉淀的物质的量(Y) 与加入试剂的量(X)之间的关系正确的是
| A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡 |
| B.向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 |
| C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量 |
| D.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量 |