如图所示,用铁棒和石墨棒作电极电解1L 1mol/L食盐水,下列有关说法 正确的是 ( )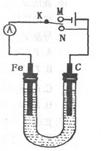
| A.电键K与N连接,铁棒被保护而免受腐蚀 |
| B.电键K与N连接,正极反应式为:4OH--4e-=2H2O +O2 ↑ |
| C.电键K与M连接,将石墨棒换成铜棒,就可实现在铁棒上镀铜 |
| D.电键K与M连接,当两极共产生标准状况下气体33.6L时,理论上生成lmol NaOH |
A、B、C、D、E都是中学化学中常见物质,它们均含有同一种短周期元素,在一定条件下可发生如图所示的转化,其中A是单质,B在常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。下列判断中不合理的是 ( )。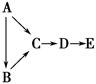
A.A不可能是金属
B.由C生成D肯定发生了电子转移
C.A生成C肯定属于离子反应
D.B和E可能会发生反应生成一种盐
下列转化关系中,不能通过一步反应实现的是 ( )。
①SiO2→Na2SiO3 ②CuSO4→CuCl2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2 ⑤Na2O2→Na2SO4
| A.①和② | B.③和④ | C.②③④ | D.②③④⑤ |
25 ℃时,x mol·L-1氢氟酸水溶液中,加入KOH固体调节溶液的pH(忽略加入固体引起的溶液体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是 ( )。
| A.当c(F-)>c(HF)时,溶液呈碱性 |
| B.当pH=2时,c(F-)<c(K+) |
| C.25 ℃时,氢氟酸的电离平衡常数为4×10-6 |
| D.当pH=5时,c(HF)+c(K+)+c(H+)-c(OH-)=x mol·L-1 |
下列各溶液中,微粒的物质的量浓度关系表述正确的是 ( )。
| A.0.1 mol·L-1 Na2CO3溶液中:c(Na+)=c(HCO3—)+c(H2CO3)+2c(CO32—) |
| B.常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 |
| C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 |
常温时,将a1 mL、b1 mol·L-1的CH3COOH溶液加入到a2 mL、b2 mol·L-1的NaOH溶液中,下列结论中正确的是 ( )。
| A.如果a1b1=a2b2,则混合溶液的pH=7 |
| B.如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) |
| C.如果a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+) |
| D.如果a1=a2,且混合溶液的pH>7,则b1<b2 |