在图1所示密闭容器中充满红棕色的NO2气体,当迅速将活塞向右推一段距离后保持活塞不动时,色度计测出颜色变化的情况如图2所示。如果迅速将活塞往左拉一段距离后保持活塞不动时,色度计测出颜色变化的情况正确的图示为

图1 图2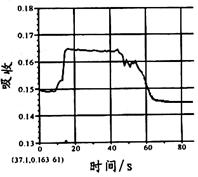
A. B. 

C. D .
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排汇,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,六价格的毒性最大,几乎是三倍铬毒性的100倍。下列叙述错误的是
| A.K2Cr2O7可以氧化乙醇,所以该反应常用于检查酒后驾驶 |
| B.污水中的铬一般为三价铬,但在溶解氧的作用下可被氧化为六价铬 |
| C.发生铬中毒时,可用维生素C缓解性,说明维生素C具有还原性 |
| D.配平Cr2O72-+I-+H+→Cr3++I2+H2O后,Cr3+的化学计量数是4 |
两种短元素X和Y的原子最外层电子数分别为1和7。下列说法正确的是
| A.元素X、Y的质子之和为12 |
| B.元素X和Y形成的可能是共价化合物 |
| C.元素X、Y分别位于周期表的ⅠA族和ⅦA族 |
D.用电子式表示X、Y原子形成化合物XY的过程如下: |
 表示阿伏伽德罗常数,下列判断正确的是
表示阿伏伽德罗常数,下列判断正确的是
A.在18 中含有 中含有 个氧原子 个氧原子 |
B.标准状况下,22.4L空气含有 个单质分子 个单质分子 |
C.1 molCl2参加反应转移电子数一定为2 |
| D.1.7g H2O2中含有的电子数为0.9 NA |
如图是一种航天器能量储存系统原理示意图。下列说法正确的是
| A.该系统中只存在3种形式的能量转化 |
B.装置Y中负极的电极反应式为: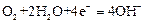 |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
下列液体均处于25℃,有关叙述正确的是
| A.某物质的溶液pH< 7,则该物质一定是酸或强酸弱碱盐 |
B.pH=4.5的番茄汁中c(H+) 是pH=6.5的牛奶中c(H+)的100倍 是pH=6.5的牛奶中c(H+)的100倍 |
| C.在同物质的量浓度的CaCl2和NaCl溶液中,AgCl的溶解度相等 |
D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO- ) ) |