I.现将反应2Fe3+ + 2I- 2Fe2+ + I2设计成如下图所示的原电池
2Fe2+ + I2设计成如下图所示的原电池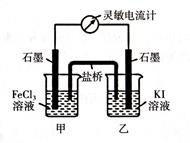
(1)能说明反应达到平衡的标志是__________;(填序号)
a.电流计读数为零 b.电流计指针不再偏转且不为零 c.电流计指针偏转角度最大
(2)若盐桥中装有琼脂-饱和KCl溶液,反应过程中的Cl-移向烧杯________;(填“甲”或“乙”)
(3)反应达到平衡后,向甲中加入适量FeCl2固体,此时___________(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为____________________________。
II.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。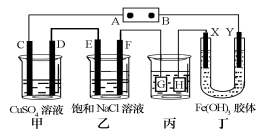
(4)装置乙中电极F的电极反应式____________________;
(5)相同条件下,装置甲、乙的C、E电极生成物质的体积之比为____________________;
(6)欲用装置丙进行粗铜精炼,电极G应该是____________________;
(7)装置丁中电极_______附近红褐色变深,说明氢氧化铁胶粒带正电荷。
A、B、C、D是元素周期表中前三周期里的四种元素,A能与D组成AD2型化合物,AD2中核外电子总数是30,离子D—的核外电子排布与Al3+相同;B和C可以形成BC型化合物,BC分子中质子总数是18,BC水溶液是一种强酸,试回答:
(1)写出上述四种元素的名称:A______,B______,C______,D______。
(2)写出AD2的电子式 :__________,属于。
(3)D单质与水反应的化学方程式为_________________________________________。
A、B、C三种常见的短周期元素可以形成AB2、C2B、AB3、C2A2、B2等物质。已知B离子和C离子有相同的电子层结构,A离子比B离子多一个电子层,请回答:
(1)A元素的名称是,B元素的符号是 ,C离子的电子式是。
(2)写出C2B 的电子式 。
(3)AB3的水化物跟C2B2反应,该反应的化学方程式是。
(4)AB3的水化物溶液跟C2B溶液反应的离子方程式是,此反应物之一跟AB2反应的化学方程式是。
金属镁在氮气中燃烧生成Mg3N2,它与水反应生成NH3和Mg(OH)2。请回答以下问题:
(1)Mg3N2的电子式可表示为____________________,由________键组成。
(2)Mg3N2与盐酸反应生成_______种盐,分别为_______________________________。
(3)NH4Cl的电子式为______________________,NH5的电子式为_________________。
(4)r(N3—)________r(Mg2+)(填“>”、“=”或“<”)=
有A、B、C、D四种元素,A的+2价离子与氩原子的电子结构相同,B原子有三个电子层,其单质为双原子分子。C的核外电子比A少一个,D与B同周期,其单质为淡黄色固体。
(1)写出A、B、C、D的离子符号:______________________。
(2)A、B、C、D的离子半径由小到大的顺序是:____________________________。
(3)写出A与B、C与D形成的化合物的电子式_________________________。
A+、B+、C—、D、E五种微粒(分子或离子),它们都分别含有10个电子,已知它们有如下转化关系:
①A++C—→D+E↑②B++C—→2D
(1)写出①的离子方程式:________________________________。
写出②的离子方程式:________________________________。
(2)除D、E外,请再写出两种含10个电子的分子:___________________。
(3)除A+、B+外,请再写出两种含10个电子的阳离子:_________________。