还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下: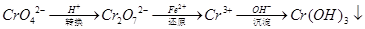
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到达平衡状态 |
| B.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5 |
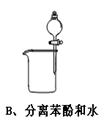
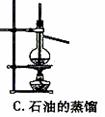
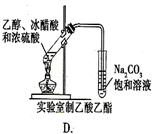
下图中所示的实验方法、装置或操作完全正确的是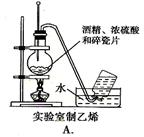
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2的化合物是:
A.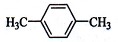 |
B.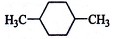 |
C.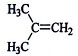 |
D.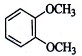 |
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是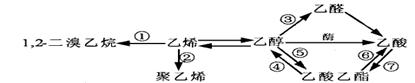
| A.反应①是加成反应 | B.只有反应②是加聚反应 |
| C.只有反应⑦是取代反应 | D.反应④⑤⑥是取代反应 |
设阿伏加德罗常数为NA,则下列说法正确的是
| A.1.5g甲基(—CH3)所含有的电子数是NA |
B.1mol 1,3一丁二烯分子中含有的 数为NA 数为NA |
| C.标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA |
| D.常温常压下,1mol CnH2n+2中所含有的共价键数目为(3n+1)NA |
含有一个双键的烯烃,加氢后产物的键线式为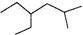 ,这种烯烃有
,这种烯烃有
| A.1种 | B.3种 | C.5种 | D.7种 |