“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g) 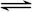 1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
_______________________________________________________________________。
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:___________________________________。
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为______________mol。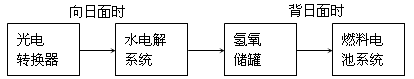
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH——4e— = O2↑+2H2O,则阴极反应为:____________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?_______,理由是:___________________________________。
Ⅰ.中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、、。
Ⅱ.熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- →34CO2+10H2O。试回答下列问题:
(1)正极电极反应式为。
(2)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是,它来自。
(18分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。这一材料是由江苏华信塑业发展有限公司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为: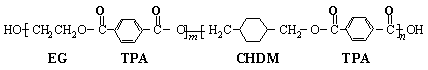
已知:
(1)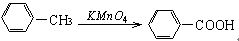
(2)RCOOR1 +R2OH RCOOR2 +R1OH (R、R1、R2表示烃基)
RCOOR2 +R1OH (R、R1、R2表示烃基)
这种材料可采用以下合成路线: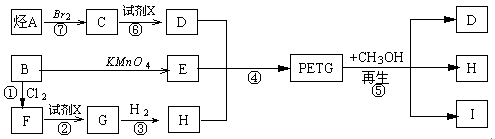
试回答下列问题:
(1)反应②⑥加入的试剂X是______________________
(2)⑤的反应类型是______________________
(3)写出结构简式:B:________H:__________I:____________
(4)合成时应控制的单体的物质的量
n(D)∶n(E)∶n(H)= _____∶______∶______(用m、n表示)
(5)写出化学方程式:
反应③:________________________________________________________
反应⑥:_______________________________________________________
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH—、C1—、CO32—、NO3—、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。试回答下列问题:
(1)写出D为_________________
(2)将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:_____________________。
(3)写出E溶液与过量的B溶液反应的离子方程式__________________________。
(4)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H=-aKJ·mol-1。请写出B与C的稀溶液反应的热化学方程式______________________________
(5)在100 mL0.1 mol·L-1E溶液中,逐滴加入35 mL 2 mol·L-1NaOH溶液,最终得到沉淀物质的量为_____。
(12分)短周期的四种元素X、Y、Z、W,原子系数依次增大,Z原子最外层电子数是X、Y、W三种原子的最外层电子数之和,Z与X、Y、W三种元素形成原子个数之比为1:1的化合物分别是A.B.C,其中化合物C在空气中容易变质,请回答:
(1)写出Z的原子结构示意图______________________________。
(2)写出化合物YZ2电子式:______________空间构形为:_______________,
写出化合物C的电子式:_____________化学键类型有:_____________。
(3)写出化合物C在空气中变质的化学方程式:____________________
(15分)甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下,发生如下反应制得: 。请根据图示回答下列问题:
。请根据图示回答下列问题:
(1)从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________。
(2)写出该反应的热化学方程式________________
(3)恒容条件下,下列措施中能使 增大的有________________
增大的有________________
A升高温度B充人He气
C再充入1molCO和2mol H 2 D使用催化剂
(4)若在温度和容器相同的三个密闭容器中,按不同方式投人反应物.,测得反应达到平衡吋的有关数据如下表:
则下列关系正确的是________
A c1=c2 B. 
C. 2a1=a3 D. a1 +a2 =1
E该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(5)若在一体积可变的密闭容器中充入l mol CO 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动,理由是________________