常温下,浓度均为0.1 mol/L的4种溶液pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
4.0 |
下列说法正确的是( )
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)
将两个铂电极插入500mLCuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g (设电解时该电极无氢气析出,且不考虑水解和溶液体积变化)。此时溶液中氢离子浓度约为
| A.4×10-3kJ·mol-1 | B.2×10-3kJ·mol-1 | C.1×10-3kJ·mol-1 | D.1×10-7kJ·mol-1 |
下列四种溶液①pH=0的盐酸②0.1 kJ·mol-1的盐酸③0.01 kJ·mol-1的NaOH溶液④pH=11的NaOH溶液由水电离出的氢离子浓度之比为
| A.1∶10∶100∶1000 | B.0∶1∶12∶11 |
| C.14∶13∶12∶11 | D.14∶13∶2∶3 |
下图曲线a表示放热反应 X(g)+Y(g)  Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是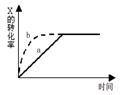
| A.升高温度 | B.加大X的投入量 |
| C.加催化剂 | D.增大体积 |
可逆反应N2+3H2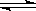 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
| A.3u正(N2)=u正(H2) | B.u正(N2)=u逆(NH3) | C.2u正(H2)=3u逆(NH3) | D.u正(N2)=3u逆(H2) |
在钢铁发生吸氧腐蚀时,正极上发生的电极反应是
| A.2H++2e-=H2 | B.Fe2++2e-=Fe |
| C.2H2O+O2+4e-=4OH- | D.Fe3++e-=Fe2+ |