纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ |
用炭粉在高温条件下还原CuO |
| 方法Ⅱ |
电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 。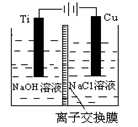
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: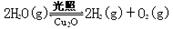 △H >0
△H >0
水蒸气的浓度随时间t变化如下表所示。
| 序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
下列叙述正确的是 (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
据报道, 在全国各地发生了多起混合洁污剂发生氯气中毒的事件,发生反应的离子方程式是:ClO-+Cl-+2H+=Cl2↑+H2O,则该离子反应中氧化剂是_________,还原剂是__________,电子转移数是mol。
在全国各地发生了多起混合洁污剂发生氯气中毒的事件,发生反应的离子方程式是:ClO-+Cl-+2H+=Cl2↑+H2O,则该离子反应中氧化剂是_________,还原剂是__________,电子转移数是mol。
(8分)实验室里迅速制备少量氯气可利用以下反应:
2 KMnO4+16 HCl ="==" 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)该反应中,氧化剂是__________,还原剂是_________。
(2) 当电子转移的数目为6.02×1023个时生成的氯气的物质的量为 mol
mol
(⑶被氧化的还原剂的物质的量是 mol
mol
写出符合以下离子方程式的化学方程式各1个
(1)CO2+2OH-=CO32-+H2O __________________________________________
(2)HCO3-+H+=CO2↑+H2O _________________________________________
_________________________________________
(3)CaCO3+2H+=Ca2++CO2↑+H20 _________________________________________
(4)Zn+Cu2+=Zn2++Cu_________________________________________
(5)H++OH-=H2O _________________________________________
除去括号中杂质,写出所加试剂与反应的离子方程式。
⑴SO42-(CO32-),所加试剂:_________,离子方程式:___________________________。
⑵Cl-(SO42-),所加试剂:_________,离子方程式:___________________________。 ⑶Fe2+(Cu2+),所加试
⑶Fe2+(Cu2+),所加试 剂:_________,离子方程式:___________________________。
剂:_________,离子方程式:___________________________。
⑷NO3-(Cl-),所加试剂:_________,离子方程式:___________________________。
某溶液中可能大量存在下列阴离子中的一种或几种:SO42-、CO32-、CL-。
⑴当溶液中有大量H+存在时,则不可能大量存在。 ⑵当溶液中有大量Ba2+存在时,则不可能大量存在和
⑵当溶液中有大量Ba2+存在时,则不可能大量存在和
⑶当溶液中同时有大量Ba2+和存在时,上述阴离子都不可能大量存在。