我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2
在③中被氧化与被还原元素原子的物质的量之比为 ;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为 。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式 。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费, 为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程:
①试剂Y的名称 ;物质X最好是 (填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol·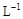 , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为;
(2)用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜晶胞的体积是cm3、晶胞的质量是g,阿伏加德罗常数为(列式计算,已知A1(Cu)=63.6);
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为。已知其中一种化合物的化学式为KCuCl3,另一种化学式为;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是,反应的化学方程式为。
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g)ΔH="+108" kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g)ΔH="+108" kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
①计算反应在第8 min时的平衡常数K=;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=mol·L-1;
④比较产物CO在2 min~3 min、5 min~6 min和12 min~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小;
⑤比较反应物COCl2在5 min~6 min和15 min~16 min时平均反应速率的大小:v(5~6)v(15~16)(填“<”、“>”或“=”),原因是。
(2)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断 (NH4)2CO3溶液的pH7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号)。
a、NH4HCO3b、NH4A c、(NH4)2CO3 d、NH4Cl
选做[化学—选修3:物质结构与性质] (15分)X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)R核外电子排布式为__________________。
(2)X、Y、Z、W形成的有机物YW(ZX2)2中Y、Z的杂化轨道类型分别为__________,ZW3-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是_____________(填化学式),原因是_________________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为______________________________________。
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为____________(填化学式)。Na+的配位数为_____________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则两个最近的W离子间距离为nm(用含ρ、NA的计算式表示)。
雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH=-113.0 kJ·mol-1
2NO2(g)ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)ΔH=_________kJ·mol-1。
SO3(g)+NO(g)ΔH=_________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1︰2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有_______________。
a.体系密度保持不变
b.混合气体颜色保持不变
c.SO2和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1︰5,则平衡常数K=_______。
(2)CO、CO2都可用于合成甲醇。
①CO用于合成甲醇反应方程式为:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_________________________________________。
②CO2用于合成甲醇反应方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
下图是科学家现正研发的,以实现上述反应在常温常压下进行的装置。写出甲槽的电极反应____________。
(3)下图是一种用NH3脱除烟气中NO的原理。
①该脱硝原理中,NO最终转化为H2O和_________(填化学式)。
②当消耗2 mol NH3和0.5 molO2时,除去的NO在标准状况下的体积为__________L。
(4)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示,写出NO分解的化学方程式_______________________________。
铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集了的气体体积均小于2.24 L(标准状况),最主要的原因是__________________________,所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因______________________________________。
(2)硫化亚铁常用于工业废水的处理。已知:25℃时,溶度积常数Ksp(FeS)=6.3×10-18、Ksp(CdS)= 3.6×10-29。请写出用硫化亚铁处理含Cd2+的工业废水的离子方程式__________________________。
(3)ZnFe2O3.5是一种新型纳米材料,可将工业废气中的某些元素转化为游离态,制取纳米ZnFe2O3.5和用于除去废气的转化关系为:ZnFe2O4 ZnFe2O3.5
ZnFe2O3.5
上述转化反应中消耗的n(ZnFe2O4)︰n(H2)=_______。请写出 ZnFe2O3.5与NO2反应的化学方程式_______________________________。
(4)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
①以FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,该反应的化学方程式为2FePO4+Li2CO3+2C=2LiFePO4+3CO↑。则1molC参与反应时转移的电子数为_______________。
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开)工作原理为FePO4+Li LiFePO4。则充电时阳极上的电极反应式为______________________________。
LiFePO4。则充电时阳极上的电极反应式为______________________________。
(5)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 mol/L 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入_______ml、2 mol/L的盐酸(忽略加入盐酸体积)。