工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: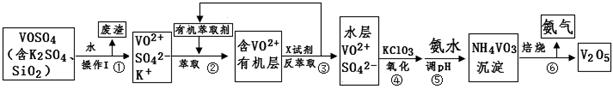
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层)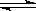 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。
下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中② 、④、⑨分别位于晶胞的体心、顶点、面心),则该
、④、⑨分别位于晶胞的体心、顶点、面心),则该 化合物的化学式为(用对应的元素符号表示)。
化合物的化学式为(用对应的元素符号表示)。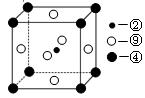
(2)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是。
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(3)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的X分子的结构式为;该元素还可与元素①形成10电子的气体分子Y ,将过量的Y气体通入盛有硝酸银水溶液的试管里,发生化学反应所对应的离子方程式为
。
(4)下表为原子序 数依次增大的短周期元素A~F的第一到第五电离能数据。
数依次增大的短周期元素A~F的第一到第五电离能数据。
| 电离能I(eV) |
A |
B |
C |
D |
E |
F |
| I1[来源:学&科&网] |
11.3 |
14.5 |
13.6 |
5.2 |
7.6 |
6.0 |
| I2 |
24.4 |
29.6 |
35.1 |
49.3 |
15.0 |
18.8 |
| I3 |
47.9 |
47.4 |
54.9 |
71.6 |
80.1 |
28.4 |
| I4 |
64.5 |
77.5 |
77.4 |
98.9 |
109.2 |
112.0 |
| I5 |
392.1 |
97.9 |
113.9 |
138.3 |
141.3 |
153.7 |
请回答:表中的金属元素是(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是。
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的同素异形体能与B物质发生置换反应。C、D、E、F含有相等的电子数,且D是阳离子,D 与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。
与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。
(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式___________________
;同主族的第四周期元素基态原子的外围电子排布图为
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序(用元素符号回答)
(3)上述六种物质或粒子中互为等电子体的是 (写出化学式)
(写出化学式)
(4)F分子的中心原子杂化类型是,E易溶于F,其原因是
根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为:__________。
(2)写出3p轨道上有2个未成对电子的元素的符号:______________。
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的的名称是____________.
(4)第三主族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。硼酸的结构式可表示为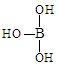 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
(5)已知:下列化学键的键能(KJ/mol),Si—O;460,Si—Si:175,O=O:498,则反应Si+O2= SiO2的反应的△H=_________
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________;
(2)由粮食发酵获得X的化学变化过程中,最主要的两个化学方程式是:
, ;
;
(3)X与金属钠反应放出氢气,反应的化学方程式是 。
。
有机物A为茉莉香型香料。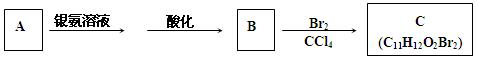
(1)A分子中含氧官能团的名称是。
(2)C的分子结构可表示为如下图(其中R代表烃基)。 A分子结构中只有一个甲基,A的结构简式是。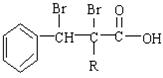
(3)B不能发生的反应是(填编号)。
| A.氧化反应 | B.加成反应 | C.取代反应 | D.水解反应 |
(4)在浓硫酸存在下,B与乙醇共热生成化合物
C13H16O2的化学方程式是。
(5)在催化剂作用下,B发生聚合反应生成聚合物的化学方程式是
。