肼(N2H4)是氮和氢形成的一种化合物,易溶于水。工业上利用尿素法生产肼,同时得到副产品十水合碳酸钠,其工艺流程如下: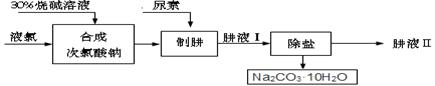
制肼过程的反应为:CO(NH2)2(尿素) + NaClO + 2NaOH = N2H4 + Na2CO3 + NaCl + H2↑
(1)实验室若配制30%烧碱溶液,所需玻璃仪器除玻璃棒外,还有 (选填编号)。
| A.漏斗 | B.烧杯 | C.烧瓶 | D.量筒 |
(2)已知:Cl2 + H2O =" HCl" + HClO(次氯酸),请推测Cl2与NaOH溶液发生反应的化学方程式: 。 从后续反应过程来看,若要使原料不浪费,合成次氯酸钠时投入的液氯与烧碱的质量之比为71 : 。
(3)在实验室中,欲从母液中分离出十水合碳酸钠晶体。可采用的操作依次为蒸发浓缩、 、洗涤。
(4)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等。请写出肼除氧时发生反应的化学方程式: 。
分析、归纳、总结、运用是学习化学的有效方法.
(1)小明用"三"对初中所学知识进行归纳总结,其中错误的是(填字母序号).
| A. |
常见的化石燃料有"三种":煤、石油、天然气 |
| B. |
水污染主要来自 "三个方面":工业污染、农业污染、生活污染 |
| C. |
一般燃烧的条件必须同时满足"三点":可燃物、与氧气接触、温度达到着火点 |
| D. |
酸、碱、盐溶液发生复分解反应时必须同时具备"三条":生成物有水、气体和沉淀 |
(2)小宇同学学习了单质、氧化物、酸、碱、盐性质后发现许多不同类别的物质反应都能生成盐,于是他构建了如右图所示的知识网络图.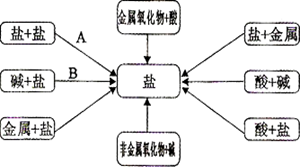
请你写出编号
所代表的一个具体的化学方程式:
.
.
(3)在 与 两个反应中 和 都是能将 还原为 的物质,在反应中作还原剂.
、分析并归纳上述两个反应还原剂中元素的化合价的变化规律.
、根据你得出的规律,判断反应 中的还原剂是.
甲物质在水中的溶解度曲线如右图所示,
、
、
为图像中的三个点。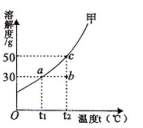
(1)
℃时将20
甲物质溶解在50
水中,所得溶液的质量为
。
(2)①若将
点溶液从
℃降温至
℃,该溶液变为(填"饱和"或"不饱和")溶液.
②该溶液的溶质质量分数(填"变大"、"变小"或"不变"),若将
点溶液变为
点溶液,
③除恒温蒸发溶剂外,还可采用的方法。
在"宏观"、"微观"、"符号"三者之间建立联系是化学学科特有的思维方式.
(1)用化学符号填空:1个铝离子;2个氮分子;如果化学符号前面的化学计量数大于1,则该符号只能表示(填"宏观"或"微观")含义.
(2)某化学反应的微观模拟图如下:( 表示氧原子
表示氧原子 表示碳原子
表示碳原子 表示氢原子)
表示氢原子)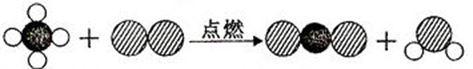
请写出该微观模拟图所表示的化学方程式.
(3)2011年3月15日,央视新闻频道《每周质量报告》特别节目披露了"健美猪"真相."健美猪'就是养猪场为了增加猪肉的瘦肉量而使用"瘦肉精"喂养生猪.人食用瘦肉精喂养的猪肉会对人体健康造成伤害.瘦肉精有多种,盐酸莱克多巴胺是"瘦肉精"的一种,它的化学式为 ,它是由种元素组成,每个分子中含有个原子.
有六种物质:
a.食盐 b.熟石灰 c.稀盐酸 d.硝酸钾 e.明矾 f.碳酸氢钠。请据此回答(填字母编号)
(1)常用于改良酸性土壤;
(2)可用于金属除锈的是;
(3)属于复合肥料的是;
(4)可用于治疗胃酸过多症的是;
(5)常用作净水剂的是。
气体的实验室制取是初中化学重要的实验。请你结合下列实验装置图,回答有关问题:
(1)写出图中①仪器的名称:。
(2)实验室用过氧化氢溶液和二氧化锰制氧气时,可选(填字母)装置作为发生装置。
(3)写出加热高锰酸钾制取氧气的化学方程式:。
(4)如果用C装置收集氧气,气体应从(填"a"或"b")端管口通入。