应用元素周期律和元素周期表,判断下列说法正确的是( )
| A.碱金属单质的熔点随原子序数的增大而降低 |
| B.砹(At)是VIIA族元素,HAt的稳定性大于HCl |
| C.第2周期非金属的气态氢化物溶于水后所得溶液均为酸性 |
| D.铊(TI)与铝同主族,其单质既能与盐酸反应又能与NaOH溶液反应 |
经测定,由CH3CHO和C6H12组成的混合物中碳的质量分数为a,则此混合物中氧的质量分数为()
A.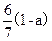 |
B. |
C.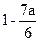 |
D.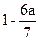 |
下列画有横线的物质在反应中不能完全被消耗的是()
| A.将1molCu置于含2molH2SO4的浓硫酸中加热 |
| B.将含少量CO2的CO气体通入盛有足量Na2O2的密闭容器中,并不断用电火花引燃 |
| C.将1 mol Mg置于11.2 L(标准状况)空气中在高温下反应 |
| D.在强光持续照射下,向过量的Ca(ClO)2悬浊液中通入少量CO2 |
下列药品和装置合理,能完成相应实验的是()
某有机物分子式为C18H23C13O4,分子中不含环和叁键,则分子中的双键数值为()
| A.4 | B.5 | C.6 | D.7 |
向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如下图所示。则下列分析与判断不正确的是(不计CO2的溶解)()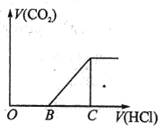
| A.若OB=0,则形成溶液M所发生的离子反应方程式为:OH-+CO2=HCO3- |
| B.若OB=BC,则溶液M为Na2CO3溶液 |
| C.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3- |
| D.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3) |