在无色溶液中,下列离子能大量共存的是
| A.Na+、NH4+、NO3-、MnO4- | B.Mg2+、SO42-、K +、Cl- |
| C.K +、Cu2+ 、Cl-、Br- | D.Ba2+ 、Na+ 、OH-、HCO3- |
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
| A.在自然界中只以化合态的形式存在 |
| B.单质常用作半导体材料和光导纤维 |
| C.最高价氧化物不与酸反应 |
| D.气态氢化物比甲烷稳定 |
元素的原子结构决定其性质和周期表中的位置。下列说法正确的是
| A.元素原子的最外层电子数等于元素的最高化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.P,S,Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 |
| D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
下列各组中两种微粒所含电子数不相等的是
| A.H3O+和OH- | B.CO和N2 | C.HNO2和NO2- | D.CH3+和NH4+ |
元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径.X元素为
| A.Al | B.P | C.Ar | D.K |
“玉兔”号月球车用 Pu作为热源材料。下列关于
Pu作为热源材料。下列关于 Pu的说法正确的是
Pu的说法正确的是
A. Pu与 Pu与 U互为同位素 U互为同位素 |
B. Pu与 Pu与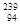 Pu互为同素异形体 Pu互为同素异形体 |
C. Pu与 Pu与 U具有完全相同的化学性质 U具有完全相同的化学性质 |
D. Pu与 Pu与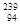 Pu具有相同的最外层电子数 Pu具有相同的最外层电子数 |