(8分)有机物A、B、C、D有如下性质。
(1)具有支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色。1molA
和1mol NaHCO3能完全反应,则A的结构简式是 。
写出与A具有相同官能团的A的所有同分异构体的结构简式
。
(2)化合物B含有C、H、O三种元素,分子量为60,其中碳的质量分数为60%,氢的质量分数为13.33%。B在催化剂Cu的作用下被氧化成C,C能发生银镜反应,则B的结构简式是 。
(3)D在NaOH水溶液中加热反应,可生成A的钠盐和B,相应反应的化学方程式是
。
下图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.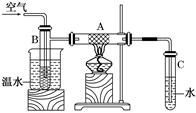
(1)撤去A处酒精灯后铜丝仍然能保持红热的原因是
________________________________________________________________________.
(2)反应后将试管C中的液体冷却,取出少量,加入到新制的Cu(OH)2悬浊液中,加热到沸腾可观察到现象是____________.写出反应的化学方程式_____________________.
A和B两种物质的分子式都是C7H8O,它们都能跟金属钠反应放出氢气.A不溶于NaOH溶液,而B能溶于NaOH溶液.B能使适量溴水褪色,并产生白色沉淀,A不能.B苯环的一溴代物有两种结构.
(1)写出A和B的结构简式.
A:__________________;B.________________.
(2)写出B与NaOH溶液起反应的化学方程式:
________________________________________________________________________.
为了确定CH3COOH、 及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验: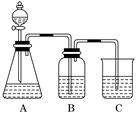
(1)若锥形瓶中装有一种易溶于水的正盐固体,则A中发生反应的离子方程式为________________________________________________________________________.
(2)装置B中盛放的试剂是________,它的作用是___________________________
______________________________________________________________________.
(3)实验中观察到C中出现的主要现象是_________________________________
________________________________________________________________________.
醇和酚在人类生产和生活中扮演着重要的角色,根据醇和酚的概念和性质回答下列问题.
(1)下列物质属于醇类的是________.
①CH3CH2CH2OH
②CH3CH(OH)CH3
③CH2===CH—CH2OH
④CH2OH—CH2OH
(2)司机酒后驾车时可检测他呼出的气体,所利用的化学反应如下:
2CrO3(红色)+3C2H5OH+3H2SO4===Cr2(SO4)3(绿色)+3CH3CHO+6H2O
被检测的气体成分是________,上述反应中的氧化剂是________,还原剂是________.
(3)300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了
蓝黑墨水.没食子酸的结构式为: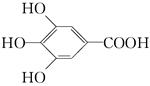 用没食子酸制造墨水主要利用了________类化合物的性质(填代号).
用没食子酸制造墨水主要利用了________类化合物的性质(填代号).
| A.醇 | B.酚 | C.油脂 | D.羧酸 |
把少量的苯酚晶体放入试管中,加入少量水振荡,溶液里出现________,因为__________________________.逐渐滴入稀NaOH溶液,继续振荡,溶液变为________,其离子方程式为__________________________.向澄清的溶液中通入过量CO2,溶液又变为________,其离子方程式为__________________________.