800℃时在2L密闭容器内反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)达平衡时NO的转化率_________________。
(2)下图中表示NO2的变化的曲线是________,
用O2表示从0~2s内该反应的平均速率v(O2)=_____。 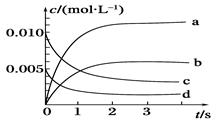
(3)能说明该反应一定达到平衡状态的是_ _
A.v(NO2)=2v(O2) B.容器内颜色保持不变
C.2V逆 (NO)=v正(O2) D.容器内压强保持不变
(4)能增大该反应的反应速率是
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是
| A.点①所示溶液中: c(H+)/c(OH—)=1012 |
| B.点②所示溶液中: c(K+)+c(H+)=c(HC2O4—)+c(C2O42-)+c(OH—) |
| C.点③所示溶液中:c(K+)>c(HC2O4—)> c(H2C2O4)>c(C2O42-) |
| D.点④所示溶液中:c(K+)+ c(H2C2O4)+ c(HC2O4—) +c(C2O42-)=0.10mol·L-1 |
化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法正确的是
| A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 |
| B.曲线图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时pH变化 |
| C.曲线图③可以表示相同pH的CH3COOH和HCl溶液分别加水稀释时溶液的pH随溶液体积变化的曲线 |
| D.曲线图④可以表示所有的固体物质溶解度随温度的变化 |
下列实验装置,其中按要求设计正确的是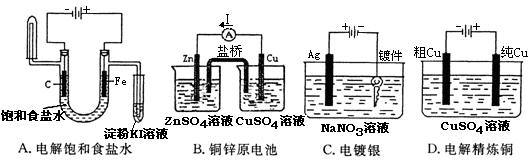
下列说法正确的是
| A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积一定是个常数 |
| B.AgCl的Ksp=1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2 |
| C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中加入少量盐酸,Ksp值变大 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O |
| D.正极上发生的反应为:O2 + 4e-+ 2H2O = 4OH- |