[有机化学基础]已知化合物G的合成路线如下:
(1)反应Ⅰ的反应类型为_____________,反应Ⅵ的反应类型为 。
(2)写出反应Ⅱ的化学方程式_____________________。写出反应Ⅲ的化学方程式____________。
(3)已知麦克尔反应:  ,反应Ⅵ属于上面列出的麦克尔反应类型,且F的核磁共振氢谱有两个吸收峰,面积比为3:1,则F的结构简式为 。
,反应Ⅵ属于上面列出的麦克尔反应类型,且F的核磁共振氢谱有两个吸收峰,面积比为3:1,则F的结构简式为 。
(4)写出检验C物质中官能团的方法和现象____________________________________。
(5)比G少2个氢原子的物质具有下列性质:
①遇FeCl3溶液显紫色; ②苯环上的一氯取代物只有一种;
③1mol物质最多可消耗1mol NaOH; ④不考虑氧原子连接在一起的情况。
符合该要求的有机物有_______种,任写两种该物质的结构简式 。
柠檬醛是一种用于合成香料的工业原料。经分析测定柠檬醛分子结构呈链状,碳原子的排列方式可以划分为若干个异戊二烯(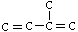 )分子的碳链结构,相对分子质量为152。
)分子的碳链结构,相对分子质量为152。
现取1 mol柠檬醛在氧气中充分燃烧,产物为CO2和H2O,且生成CO2的物质的量比H2O多2 mol。
试填写下列空白:
(1)柠檬醛的分子式为,结构简式为。
(2)设计一实验,证明柠檬醛分子结构中含有醛基(简要说明所用的试剂、实验步骤、实现现象和结论)。
。
(3)已知溴水能氧化醛基,若要检验其中的碳碳双键,其实验方法是。
(4)柠檬醛分子有多种同分异构体,请写出属于醇类、分子结构中不含甲基和不饱和碳原子的任意一种同分异构体的结构简式。
(届河北省唐山市高三4月第二次模拟理综化学试卷)
5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
| 阳离子 |
Na+ Al3+Fe3+ Cu2+、 Ba2+ |
| 阴离子 |
OH- Cl- CO32- NO3- SO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol·L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A、C的化学式为:A;C。
(2)写出步骤②中发生反应的化学方程式。
(3)D溶液中滴入石蕊试液,现象是,
原因是(用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是mL。
(5)现用500 mL 3 mol·L-1的E溶液充分吸收11.2 L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为。
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水)。 ’
’
(届江西省景德镇市高三第一次模拟考试卷理综化学试卷)
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 |
H+ |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
未测定 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH=。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)="CO" (g)△H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
① 若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为N2 (g)+O2(g)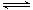 2NO(g)△H
2NO(g)△H 0
0
1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K=。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
③ 汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)
已知该反应的△H 0,判断该设想能否实现并简述其依据:。
0,判断该设想能否实现并简述其依据:。
(届河南省商丘市高三第二次模拟考试理综化学试卷)
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理, 回答下列问题: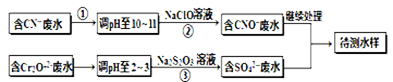
(1)上述处理废水流程中主要使用的方法是。
(2)②中反应后无气体放出,该反应的离子方程式为。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液, 蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,下列结论正确的是。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,下列结论正确的是。
| A.x ="0.5" ,a =8 | B.x ="0.5" ,a = 10 | C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
① 工业合成氨的热化学方程式是 。
② 若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则
Q(填“>”、“<”或“=”)_______184.4 kJ。
③ 已知:
1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH(填“>”、“<”或“=”) 0
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)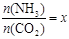 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。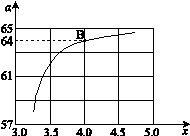
③ 上图中的B点处,NH3的平衡转化率为_______。
(3)氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
下面是利用氮气制备含氮化合物的一种途径:
①过程Ⅱ的化学方程式是
②运输时,严禁NH3与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,并且0.4 mol NH3参加反应时有0.3 mol 电子转移。写出反应的化学方程式
③氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH =" ―1316" kJ/mol,则该燃料电池的负极反应式是 。