合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)  2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( ) 
| A.c点处正反应速率和逆反应速率相等 |
| B.a点处正反应速率比b点处的大 |
| C.d点(t1时刻)和e点(t2时刻)处n(N2)不同 |
| D.t2时刻,正反应速率大于逆反应速率 |
若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是 ( )
| A.K+、Na+、Cl-、NO3- | B.Al3+、Na+、NO3-、Cl- |
| C.K+、Na+、Cl-、AlO2- | D.K+、NH4+、SO42-、NO3- |
已知热化学方程式:2SO2(g)+O2(g) 2SO3(g) △H= -QkJ·mol—1(Q>0)。下列说法正确的是 ( )
2SO3(g) △H= -QkJ·mol—1(Q>0)。下列说法正确的是 ( )
| A.相同条件下,2molSO2和1molO2所具有的能量小于2molSO3所具有的能量 |
| B.将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,放出热量为QkJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化 |
国际石油价格多次上涨,为解决能源危机,现在全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。已知热化学方程式:1/2C2H5OH(l)+3/2O2(g) = CO2(g)+3/2H2O(l) △H=-683.4kJ/mol。下列有关说法正确的是 ( )
| A.乙醇汽油是一种清洁能源,燃烧不会产生任何污染 |
| B.在25℃、101KPa时,生成1mol水时放出683.4kJ的热量 |
| C.乙醇的燃烧热为683.4kJ/mol |
| D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ/mol |
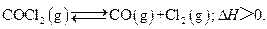 当反应达到平衡时,下列措施:
当反应达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是()
| A.①②④ | B.①④⑥ |
C.②③⑥ | D.③⑤⑥ |
两个极易导热的密闭容器A和B(保持恒温),容器A容积恒定,容器B容积可变,在温度压强和起始体积相同的条件下往A和B中分别充入等物质的量的NO2,发生反应2NO2 N2O4 △H<0,以下说法正确的是 ( )
N2O4 △H<0,以下说法正确的是 ( )
A.反应起始时,两容器中的反应速率关系是v(A)<v(B)
B.反应过程中,两容器内的反应速率关系为v(A)<v(B)
C.两容器内的反应达到平衡所需时间一定相同
D.反应达到平衡时,两容器内的压强关系是p(A)>p(B)