实验测得BeCl2为共价化合物,两个Be—Cl键间的夹角为180°,以下判断正确的是( )
| A.由极性键构成的极性分子 | B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.BeCl2中Be采取sp2杂化 |
对于某些离子的检验及结论一定正确的是
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,可能有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42— |
| C.加硝酸银溶液产生白色沉淀,一定有Cl- |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
下列叙述正确的是
| A.同温同压下,相同体积的物质,其物质的量一定相等 |
| B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
| C.1L一氧化碳气体一定比1L氧气的质量小 |
| D.一氧化碳气体和氮气,若体积相等,则质量一定相等 |
相同温度下,在两个等体积的密闭容器中,分别充入氦气、氮气两种气体,当它们的密度都相同时,这两种气体的物质的量之比是
| A.7∶2 | B.2∶7 | C.1∶7 | D.7∶1 |
容量瓶标有
①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式
| A.①③⑤ | B.③⑤⑥ |
| C.①②④ | D.②④⑥ |
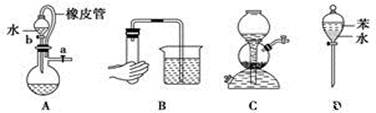
下列实验装置图中没有涉及气体压强原理的是