化学变化的实质是旧的化学键断裂、新的化学键形成。据此判断下列变化是化学变化的是
| A.固体氯化钠溶于水 | B.冰经加热变成水蒸气 |
| C.氯化铵受热分解生成氯化氢和氨气 | D.氯化氢溶于水 |
在图⑴中A、B两个容器里,分别收集着两个作用不同的理想气体。若将中间活塞打开[如图⑵],两种气体分子立即都占有了两个容器。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是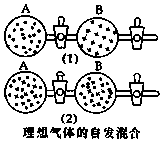
A.此过程是从混乱程度小的向混乱程度大变化过程,即熵增大的过程
B.此过程为自发过程,而且没有热量的吸收或放出
C.此过程从有序到无序,混乱度增大
D.此过程是自发可逆的
下列各组中的两种物质相互作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是
| A.Al和 NaOH溶液 |
| B.NaOH溶液和AlCl3溶液 |
| C.Na和O2 |
| D.NaOH溶液和CO2 |
下列表示水解的离子方程式正确的是
A.CH3COO— + H2O CH3COOH + OH— CH3COOH + OH— |
B.NH4+ + H2O NH4OH + H+ NH4OH + H+ |
C.S2— + 2H2O H2S+2OH— H2S+2OH— |
D.HCO3— + H2O  H3O++CO32— H3O++CO32— |
银在周期表中的表示如下图所示,下列叙述不正确的是
| A.银的原子序数为47 |
| B.银的摩尔质量为107.9 |
| C.银为过渡金属元素 |
| D.银原子最外层有1个电子 |
下列对摩尔(mol)的有关说法中错误的是
| A.摩尔是一个单位而非物理量 |
| B.摩尔既能用来计量纯净物,又能用来计量混合物 |
| C.1mol任何气体所含气体的分子数目都相等 |
| D.0.5mol氦约含有1.204×1024个电子 |