已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子对数与未成对电子数之比为3:1。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1∶1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
(1)D元素在元素周期表中的位置为第 周期 族。
(2)下列叙述正确的是 (填写序号)。
a.水的沸点比M高得多,是因为水分子间能形成氢键,而M分子间不能形成氢键
b.M的中心原子采用sp3杂化
c.N分子中含有6个σ键和1个大π键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)已知C2D是一种麻醉剂,根据等电子原理可推知C2D的空间构型为 。
(4)E的一种氧化物Q,其晶胞结构如图所示,则Q的化学式为 。
已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________、Z__________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的结构式为:,它的共价键属于(填:极性、非极性)键;含有离子键和非极性共价键的化合物的电子式为。
(3)由X、Y、Z所形成的常见离子化合物是___________,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为:_________________________ ;
X与W形成的化合物与水反应时,水作的是(填:氧化剂、还原剂)。
已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是;
(2)B和C的分子式相对稳定的是;
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。该反应的化学方程式为。
(4) 若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是。
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下: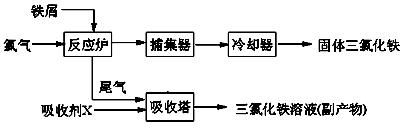
(1)试写出吸收塔中反应的离子方程式:____________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH20) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是:。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c mol/L Na2S2O3溶液滴定用去V mL。
( 已知:2Fe3++2I-= I2+2Fe2+I2+2S2O32-=2I- +S4O62-)
①滴定终点的现象是:____________________________。
②样品中氯化铁的质量分数为__________________。
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法: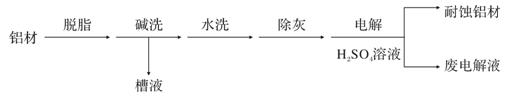
① 碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是____(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的____.。
a.NH3 b.CO2 c.NaOH d.HNO3
② 以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为____。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生此现象的原因(用离子方程式表示)_____。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极材料的原因是______。
(3)利用下图装置,可以模拟铁的电化学防护。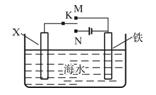
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚(CH3OCH3)。
请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:(甲醇:CH3OH)
① 2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
则利用水煤气合成二甲醚的总反应的热化学方程式为______________________.
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(2)、 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。