一定量混合气体在密闭容器中发生如下反应:mA(g)+nB(g)  pC(g),达到平衡后,温度不变,将气体体积压缩到1/2,当达到平衡时C的浓度为原来的1.9倍,则下列叙述正确的是( )
pC(g),达到平衡后,温度不变,将气体体积压缩到1/2,当达到平衡时C的浓度为原来的1.9倍,则下列叙述正确的是( )
| A.m+n>p | B.A的转化率增加 |
| C.平衡向逆反应方向移动 | D.C的体积分数增大 |
下列物质中,不能导电,但是电解质的是( )
| A.铜丝 | B.MgCl2固体 | C.NaCl溶液 | D.乙醇 |
将下列各组物质按酸、碱、氧化物分类顺序排列。正确的是()
| A.硝酸,烧碱,水 | B.盐酸,熟石灰,苛性钠 |
| C.碳酸,乙醇,生石灰 | D.硫酸,纯碱,石灰石 |
下列物质中,不属于合金的是()
| A.硬铝 | B.黄铜 | C.钢铁 | D.水银 |
向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示。以下结论不正确的是()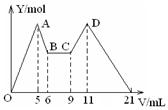
| A.从6到9,相应离子反应方程式为H++OH-=H2O |
| B.A 是NaOH,B是盐酸,且c(NaOH):c( HCl) = 2:1 |
| C.原混合液中,c(Al3+):c(Mg2+):c(Cl-) = 1:1:5 |
| D.A是盐酸,B是NaOH, 且c(NaOH) =" 2c" (HCl) |
已知2Fe3+ +Cu=Cu2+ +2Fe2+,现把相同物质的量的硫酸铜,氯化铁和锌置于水中充分反应后,反应器中所得混合物除含SO42-和Cl-外, 还含有( )
| A.Zn2+、Cu、Fe3+ | B.Zn、Cu2+、Fe3+ |
| C.Zn2+、Cu2+、Cu、Fe2+ | D.Zn2+、Cu2+、Fe、Fe2+ |