大胆科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定没有意义的是
| A.探究SO2与Na2O2反应可能有Na2SO4生成 |
| B.探究浓H2SO4与铜在一定条件下反应产生的黑色物质中可能有CuS |
| C.探究Na与水的反应可能生成NaOH和H2O2 |
| D.探究向滴有酚酞试液的NaOH溶液中通以Cl2,酚酞红色褪去的现象是溶液的酸碱性变化所致,还是HClO的漂白性 |
下列说法正确的是 ()
| A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B.因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少 |
| C.物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO43-的物质的量浓度相同 |
| D.足量Zn分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不等 |
下列叙述中,正确的是
| A.只用溴水一种试剂既可鉴别苯、己烯、乙醇、四氯化碳四种液体 |
| B.用浓HNO3可区分纯棉织物和真丝制品 |
| C.所有糖类物质都有甜味,但不一定都溶于水 |
| D.油脂、葡萄糖、纤维素都可以发生水解反应 |
下列各组化合物,不论二者以什么比例混合,只要总质量一定,则完全燃烧时,消耗O2的质量和生成水的质量不变的是
| A.C2H4 C2H2 | B.C2H6 C3H6 | C.C2H4 C3H6 | D.C2H4 C3H4 |
一学生用如图装置研究原电池原理,下列说法错误的是:
| A.(3)图中Zn片增重质量与Cu棒减轻质量的比值为65:64 |
| B.(2)图中如果两极上都有气体产生,则说明Zn片不纯 |
| C.(1)图中铜棒上没有气体产生 |
| D.(2)图与(3)图中正极生成物质质量比为1:32时,Zn棒减轻的质量相等 |
X、Y、Z三种短周期元素在周期表中的位置如右图,X通过共用三对电子形成X2分子,下列说法不正确的是 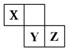
| A.化合物XZ 3中各原子均满足8电子的稳定结构 |
| B.X、Y、Z三种元素形成的含氧酸都是强酸 |
| C.常温下,Z单质可与Y的氢化物发生置换反应 |
| D.Z的气态氢化物比Y的气态氢化物更加稳定 |