下面两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。请同学们仔细观察,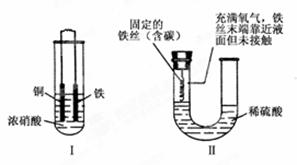
下列叙述正确的是 ( )
| A.装置Ⅰ在反应过程中自始至终只生成红棕色气体 |
| B.装置Ⅱ开始阶段铁丝只发生析氢腐蚀 |
| C.装置Ⅱ在反应过程中能产生氢气 |
| D.装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+ |
已知反应a W(g)= b Z(g)的△H < 0、△S > 0,对此反应叙述正确的是()
| A.该反应在任何情况下均能自发进行 |
| B.该反应在任何情况下均不能自发进行 |
| C.该反应在一定条件下能自发进行 |
| D.条件不足,无法判断 |
对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是()
| A.使用催化剂 | B.升高温度 |
| C.增大体系压强 | D.加入一种反应物 |
对于可逆反应:2SO2 + O2 2SO3(g)△H<0,升高温度产生的影响为()
2SO3(g)△H<0,升高温度产生的影响为()
| A.v正增大, v逆减小 | B.v正减小, v逆增大 |
| C.v正和v逆不同程度的增大 | D.v正和v逆同等程度的增大 |
下列热化学方程式或离子方程式中,正确的是()
| A.氯化镁溶液与氨水反应:Mg2+ + 2OH-= Mg(OH)2 ↓ |
B.500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)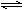 2NH3(g)△H= -38.6kJ·mol-1 2NH3(g)△H= -38.6kJ·mol-1 |
| C.甲烷的标准燃烧热△H= -890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g) + 2O2(g) = CO2(g)+2H2O(g) △H= -890.3kJ·mol-1 |
| D.氧化铝溶于NaOH溶液:Al2O3 + 2OH-=2AlO2-+ H2O |
下列说法中不正确的是()
| A.反应热指的是反应过程中吸收或放出的能量 |
| B.热化学方程式的化学计量数可表示分子的个数 |
| C.在热化学方程式中无论反应物还是生成物均必须标明聚集状态 |
| D.所有的化学反应均伴随能量变化 |