某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。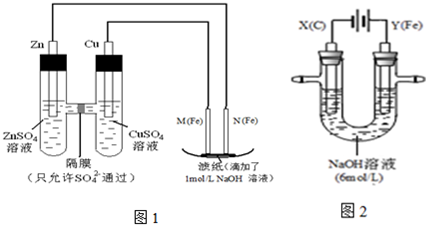
请回答:
I.用图1所示装置进行第一组实验。
(1)N极发生反应的电极反应式为 。
(2)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(4)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和4OH- - 4e-=2H2O + O2↑, 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn=Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为 。
(6)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:__________________________。
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是,其中发生反应的化学方程式为;
(2)实验过程中,装置B、C中发生的现象分别是、,这些现象分别说明SO2具有的性质是和;装置B中发生反应的离子方程式为;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象;
(4)尾气可采用溶液吸收。
A~G各物质间的关系如下图,其中B、D为气态单质。
请回答下列问题:(①中MnO2作催化剂,②中MnO2作氧化剂)
(1)物质C和E的名称分别为________________、__________________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_____________;若只能在加热情况下进行,则反应物A应为_____________;
(3)反应②的化学方程式:_______________________________________;
(4)新配制的F溶液应加入_____________以防止其转化为G。检验G溶液中阳离子的常用试剂是_____________,实验现象为____________________________。
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX ; Y、M同主族,可形成MY2、MY3两种分子。
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)X、Y、Z、M组成两种盐的溶液反应可产生MY2气体,写出其反应离子方程式:
(4)M的氧化物与G的单质的水溶液均有漂白性,相同条件下,相同体积的M的氧化物与Y的单质混合通入品红溶液,品红溶液 (填褪色或不褪色),原因(用化学方程式表示)
化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g)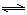 CO(g)+H2(g),则该反应的平衡常数表达式为。
CO(g)+H2(g),则该反应的平衡常数表达式为。
(2)已知在一定温度下,
C(s)+CO2(g) 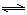 2CO(g)△H1
2CO(g)△H1
CO(g)+H2O(g) 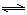 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2
C(s)+H2O(g)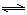 CO(g)+H2(g)△H3
CO(g)+H2(g)△H3
则△H1、△H2、△H3之间的关系是:。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g) 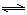 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
则该反应的正反应方向是反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g) 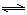 2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是:
2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是: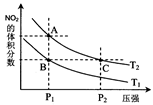
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用下图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为:,阳极区逸出气体的成分为(填化学式)。
有机物A可以通过不同的反应得到B和C: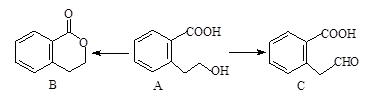
(1)A的分子式为,C的含氧官能团名称为。
(2)A制取B的有机反应类型为;A制取C的化学方程式为:。
(3)A发生消去反应后产物的结构简式为,A分子中一定共面的碳原子有个。
(4)芳香族化合物D是A的同分异构体,1molD可以和3mol NaOH发生中和反应;D苯环
上的一氯代物只有一种且分子中没有甲基。请写出D的结构简式(任写一种)。