某蓄电池放电、充电时反应为:Fe + Ni2O3 +3H2O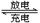 Fe(OH)2 +2Ni(OH)2,下列推断不正确的是
Fe(OH)2 +2Ni(OH)2,下列推断不正确的是
| A.放电时,Fe为正极,Ni2O3为负极 |
| B.充电时,阴极上的电极反应式是:Fe(OH)2 +2e–→Fe+2OH– |
| C.放电时,正极上的电极反应式是:Ni2O3 +3H2O+2e–→2Ni(HO)2 +2OH– |
| D.该蓄电池的电极必须是浸在某种碱性电解质溶液中 |
常温下,下列溶液中离子浓度关系表达正确的是
| A.Na2CO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) |
| B.0.1mol/L的Na2CO3溶液中:c(Na+)> c(CO32-) > c(OH-)>c(HCO3-) |
| C.pH=5.3的NaHSO3溶液:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
| D.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后:c(Na+)>c(CH3COO-)+c(OH-)+c(H+) |
常温下,下列各组离子在相应的条件下可能大量共存的是
| A.能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ |
B. 的溶液中:Na+、HCO3-、Cl-、K+ 的溶液中:Na+、HCO3-、Cl-、K+ |
| C.在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3- |
| D.由水电离产生的c(OH-)=1×10-12mol/L的溶液中:NO3-、Mg2+、Na+、SO42- |
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列三种酸的电离常数,若已知下列反应可以发生:NaCl+HNO2=HCN+NaNO2,NaNO2+HF=HNO2+NaF。据此判断,下列叙述不正确的是
| A.K(HF)=7.2×10-4 | B.K(HNO2)=4.9×10-10 |
| C.反应NaCN+HF=HCN+NaF可以发生 | D.K(HCN)<K(HNO2)<K(HF) |
室温时,将浓度和体积分别为c1,V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
| A.当pH=7时,若V1=V2,则一定是c2>c1 |
| B.在任何情况下都满足c(Na+)+ c(H+)=c(CH3COO-)+c(OH-) |
| C.若pH>7,则一定是c1V1>c2V2 |
| D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) 2Z(g) ∆H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是()
2Z(g) ∆H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是()
| A.升高温度,X的物质的量减小 |
| B.增大压强(缩小容器体积),Z的浓度不变 |
| C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变 |
| D.保持容器体积不变,充入一定量的Z,重新平衡时,Y的体积分数增大 |