常温下,用0.100 0 mol·L–1NaOH溶液滴定20.00 mL 0.100 0 mol·L–1CH3COOH溶液,滴定曲线如图。下列说法正确的是( )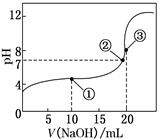
| A.点①所示溶液中:c(CH3COO–)+ c(OH–)= c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO–) |
| C.点③所示溶液中:c(Na+)>c(OH–)>c(CH3COO–)>c(H+) |
| D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO–)>c(H+)>c(Na +)>c(OH-) |
下列物质不是电解质的是
| A.NaCl | B.H2SO4 | C.NaOH | D.SO3 |
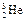 是较为安全的高效核聚变反应原料。
是较为安全的高效核聚变反应原料。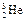 原子核内中子数是
原子核内中子数是
| A.1 | B.2 | C.3 | D.5 |
从化学试剂商店购买的某些试剂瓶上常贴有危险化学品的标志。盛装浓硫酸的试剂瓶上所贴的危险化学品标志是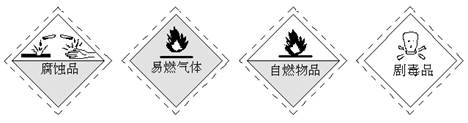
A B CD
下列是某学生总结的一些规律,其中正确的是
| A.氧化物不可能是还原产物,只可能是氧化产物 |
| B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应 |
| C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
D.将Mg(HCO3)2溶液加热,最终得到Mg(OH)2沉淀,由此可知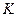 sp[Mg(OH)2] > sp[Mg(OH)2] >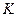 sp(Mg CO3) sp(Mg CO3) |
有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2②KCl ③NaOH ④CuSO4 ⑤Na2SO4如果不用其他任何试剂(包括试纸),用最简便的方法将它们——鉴别开来,则在下列的鉴别顺序中,最合理的是
| A.④③①⑤② | B.④①③⑤② | C.①⑤③④② | D.③④①⑤② |