实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是( )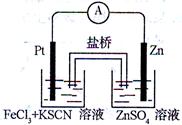
| A.该原电池的正极反应是:Zn-2e— =Zn2+ |
| B.Pt电极表面生成大量气泡 |
| C.左烧杯中溶液的红色逐渐褪去 |
| D.生成的Fe2+通过盐桥可以和锌直接反应生成Fe |
已知C-C可以绕键轴旋转,结构简式为下图的烃,下列说法正确的是: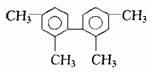
| A.分子中至少有9个碳原子处于同一平面上 |
| B.分子中至少有11个碳原子处于同一平面上 |
| C.该烃的一氯取代物最多有3种 |
| D.该烃是苯的同系物 |
下列各项叙述中,没有错误的一项是:
| A.C2H4与C4H8一定是同系物。 |
| B.用乙醇把溴从溴水中萃取出来。 |
| C.除去苯中的少量苯酚可用试剂是溴水。 |
| D.能发生银镜反应的有机物中一定含醛基。 |
检验某卤代烃中卤素的实验中,要进行的主要操作是:①加热;②滴入稀硝酸酸化;
③加入硝酸银溶液;④加入足量的氢氧化钠溶液;⑤取少量卤代烃;⑥冷却。以上各步操作的先后顺序排列正确的是:
| A.⑤④①⑥②③ | B.⑤②①⑥④③ | C.⑤③②① | D.⑤③② |
下列各组关于有机化合物的比较或说法不正确的是:
| A.苯酚的熔点比硝基苯高 | B.乙醇比乙醛水溶性好 |
| C.乙烯和聚乙烯都能使溴水褪色 | D.乙酸比硬脂酸水溶性更好 |
下列烃在核磁共振氢谱图上有三个峰的是:
| A.甲苯 | B.新戊烷 | C.异丁烷 | D.邻二甲苯 |