已知KHSO3溶液呈弱酸性。在0.1mol·L-1KHSO3溶液中,下列关系正确的是
| A.c(K+)+ c(H+) =c(HSO3-)+ c(OH-)+ c(SO32-) |
| B.c(HSO3-) + c(SO32-) = 0.1mol·L-1 |
| C.c(SO32-) < c(H2SO3) |
| D.c(K+) = c(H2SO3) + c(HSO3-) + c(SO32-) |
下列说法正确的是
①已知BaSO4的Ksp=C(Ba2+)·C(SO42-),所以在硫酸钡溶液中有C(Ba2+)=C(SO42-)= mol/L;
mol/L;
②常温下,强酸溶液的PH=a,将溶液的体积稀释到原来的10n倍,则PH=a+n;
③将0.1mol/L的NaHS和0.1mol/L的Na2S溶液等体积混合,所得溶液中有C(S2-)+2C(OH-)=2C(H+)+C(HS-)+3C(H2S);
④在0.1mol/L氨水中滴加0.1mol/L盐酸,恰好中和时PH=a,则由水电离产生的C(OH-)=10-amol/L
| A.①④ | B.②③ | C.③④ | D.①② |
可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应
①Br2 + 2e-= 2Br-②2Br- - 2e-= Br2 ③Zn – 2e-= Zn2+ ④Zn2+ + 2e-= Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
| A.②和③ | B.②和① | C.③和① | D.④和① |
下列说法正确的是
| A.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A一定是强酸 |
| B.用已知浓度的盐酸滴定未知浓度的氨水,选用最佳指示剂为酚酞 |
| C.若用50ml 0.55mol/L的NaOH溶液,分别与50ml 0.50mol/L的盐酸和50ml 0.50mol/L的硫酸充分反应,两反应的中和热相等 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4 +Na2CO3主要:Cu2+ + CO32─ + H2O = Cu(OH)2↓+ CO2↑,次要:Cu2+ + CO32─= CuCO3↓;
(2)CuSO4 +Na2S主要:Cu2+ + S2─= CuS,次要:Cu2+ + S2-+ 2H2O =Cu(OH)2↓+ H2S↑,下列几种物质的溶解度大小的比较中,正确的是
| A.Cu(OH)2>CuCO3>CuS | B.CuS >Cu(OH)2>CuCO3 |
| C.CuS <Cu(OH)2<CuCO3 | D.Cu(OH)2<CuCO3<CuS |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4 OH-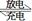 2CO32—+6H2O,则下列说法正确的是
2CO32—+6H2O,则下列说法正确的是
| A.构成该电池的正极和负极必须是两种活性不同的金属 |
| B.充电时有CH3OH生成的电极为阳极 |
| C.放电时负极的电极反应为:CH3OH-6e- +8OH- = CO32— + 6H2O |
| D.放电时,CO32—移向正极 |