如图甲、乙是电化学实验装置。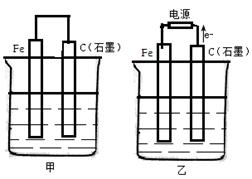
(1)若甲、乙两烧杯中均盛有NaCl溶液,则:
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2 。若反应中Cl2和I2的物质的量之比为5∶1,且 生成两种酸,该反应的化学方程式为 。
(2)若甲乙两烧杯中均盛有足量CuSO4溶液,则:
①甲中铁棒上的电极反应式为 ;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入的物质是 (写化学式),其质量为 g。
氯化铜(CuCl2·2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.





 ↓蒸发结晶
↓蒸发结晶 CuCl2·2H2O(纯)
CuCl2·2H2O(纯) (1)加入氧化剂X的目的是
(1)加入氧化剂X的目的是 (2)下列氧化剂中最适合本实验的是
(2)下列氧化剂中最适合本实验的是
| A.H2O2 | B.KMnO4 | C.NaClO | D.K2Cr2O7 |
 (3)物质Y和沉淀Z的化学式分别是 和 .
(3)物质Y和沉淀Z的化学式分别是 和 . (已知完全成氢氧化物所需PH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.)
(已知完全成氢氧化物所需PH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.)
孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:xCuCO3·yCu(OH)2(x、y为正整数且x≤2,y≤2) (1)孔雀石和石青分别与过量盐酸反应时,孔雀石消耗的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1,请推算它们的化学组成。
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石消耗的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1,请推算它们的化学组成。 孔雀石__________________________;石青__________________________;
孔雀石__________________________;石青__________________________; (2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36 L(标准状况下);加热另一份样品使其完全分解,得到CuO 20 g,试通过计算确定该混合物中孔雀石和石青的物质的量之比 。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36 L(标准状况下);加热另一份样品使其完全分解,得到CuO 20 g,试通过计算确定该混合物中孔雀石和石青的物质的量之比 。
如图,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一个大烧杯,请回答:
 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________; (2)实验中观察到的主要现象是:
(2)实验中观察到的主要现象是: ①_______________________________;
①_______________________________; ②_______________________________;
②_______________________________; ③_______________________________;
③_______________________________; ④_______________________________。
④_______________________________。 (3)用该装置做铜与浓硝酸反应实验的优点:______________;
(3)用该装置做铜与浓硝酸反应实验的优点:______________; (4)大烧杯内最终所得气体产物的化学式:;若要验证此气体产物,最简便的方法:_________________________________________。
(4)大烧杯内最终所得气体产物的化学式:;若要验证此气体产物,最简便的方法:_________________________________________。
试样x由氧化亚铁和氧化铜组成.取质量相等的两份试样,按下图所示进行实验.
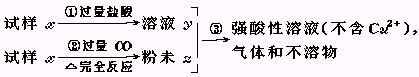
 (1)请写出步骤③中所发生的全部反应的离子方程式.
(1)请写出步骤③中所发生的全部反应的离子方程式. (2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为(用m表示).
(2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为(用m表示).
mg 铁粉与一定量的HNO3在一定条件下充分反应,将生成的气体与标准状况nL氧气混合,恰好能被水完全吸收,m和n的关系是什么?