工业制硫酸中的一步重要反应是SO2(在400-500 C下的催化氧化:2SO2+O2
C下的催化氧化:2SO2+O2 2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法错误的是
2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法错误的是
| A.在上述条件下,SO2可能100%的转化为SO3 |
| B.使用催化剂是为了加快反应速率,提高生产效率 |
| C.达到平衡时,SO2与SO3的浓度保持不变 |
| D.为了提高SO2的转化率,可以适当提高O2的浓度 |
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)  2SO3(g)△H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响.其中分析正确的是
2SO3(g)△H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响.其中分析正确的是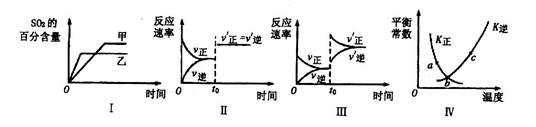
| A.图I表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中正确的是
| A.燃料电池工作时,正极反应为:O2+2H2O+4e一=40H— |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
下列说法中,正确的是
| A.增大反应物浓度,平衡正向移动,反应物的转化率一定增大 |
| B.正、逆反应速率改变时,平衡一定发生移动 |
| C.对于任何可逆反应,使用催化剂只改变反应速率,不影响平衡 |
| D.增大体系压强,化学反应速率加快,化学平衡一定正向移动 |
下列叙述正确的是
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②浓硫酸可用于于燥氢气、碘化氢等气体,但不能干燥氨气、二氧化氮气体
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤浓硫酸与铜反应既体现了其强氧化性又体现了其酸性
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质
| A.①④⑤ | B.①⑤⑥ | C.②③④ | D.④⑤⑥ |
以下四组气体分别与对应的试纸接触,均能使试纸变蓝的是