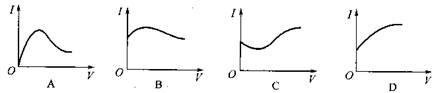同学对“CO2是共价化合物和NH4Cl是离子化合物”有下列四点感悟,其中不正确的是
| A.离子化合物中可能含共价键 | B.共价化合物中一定不含离子键 |
| C.离子化合物中不一定含金属元素 | D.离子化合物中一定不含共价键 |
已知温度T时水的离子积常数为KW, 该温度下, 将浓度为amol· L-1的一元酸HA与bmol· L-1的一元碱BOH等体积混合, 可判定该溶液呈中性的依据是
| A.a = b |
| B.混合溶液的pH = 7 |
C.混合溶液中,c(H+)=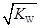 mol·L-1 mol·L-1 |
| D.混合溶液中, c (H+)+c (B+) =" c" (OH-)+c (A-) |
25℃时,水的电离达到平衡:H2O H++OH-, 下列叙述正确的是
H++OH-, 下列叙述正确的是
| A.向水中加入稀氨水, 平衡逆向移动, c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠, c(H+)增大, KW增大 |
| C.降温, 使平衡左移,c(H+)减小, 溶液呈碱性 |
| D.将水加热, KW增大,pH减小 |
对于xA(g)+yB(g) zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是
zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是
| A.x+y>z+w,正反应是放热反应 |
| B.x+y>z+w,正反应是吸热反应 |
| C.x+y<z+w,逆反应是放热反应 |
| D.x+y<z+w,正反应是吸热反应 |
下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O H3O++CO32- H3O++CO32- |
B.NH4++H2O NH3·H2O+OH- NH3·H2O+OH- |
C.PO43-+H2O HPO42-+OH- HPO42-+OH- |
D.H2O+H2O H3O++OH- H3O++OH- |
向0.1 mol·L-1醋酸溶液中逐滴加入氨水至过量时,溶液的导电能力将发生相应的变化,其电流强度(I)随加入氨水的体积(V)变化的曲线关系是下图中的