如图装置所示,铜片上发生的反应为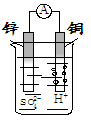
| A.Zn2+ + 2eˉ = Zn |
| B.2H+ + 2eˉ = H2↑ |
| C.Zn - 2eˉ= Zn2+ |
| D.Cu2+ + 2eˉ = Cu |
工业制A1,你认为说法不妥当的是
| A.铝便于运输、贮存,从安全角度考虑,铝是最佳燃料之一 |
| B.铝资源比较丰富,易于开采,且可以再生 |
| C.铝燃烧热大,燃烧污染小,易有效控制 |
| D.寻找高效催化剂,使A12O3分解同时释放能量,是铝能源大规模开发利用的一项关键技术 |
将4molA和2molB在2L密闭容器中混合发生反应,2A(g)+B(g) 2C(g);ΔH<0,4秒后反应达到平衡状态,此时得C的浓度为0.6mol/L,下列说法正确的是
2C(g);ΔH<0,4秒后反应达到平衡状态,此时得C的浓度为0.6mol/L,下列说法正确的是
A.当A、B、C物质的量浓度化为2︰1︰2时,反应即达到平衡状态
B.4S内用物质B表示的反应速率为0.075mol/(L·S)
C.达平衡后通入一定量的氦气,A的转化率降低
D.达平衡后升高温度,C的浓度将增大
你认为不正确的是
| A.化学反应速率理念可指导怎样在一定时间内快出产品 |
| B.化学平衡理念可指导怎样使用有限原料多出产品 |
| C.化学反应速率理论可指导怎样提高原料的转化率 |
| D.用速率理论和平衡理论都可提高化工生产的综合经济效益 |
已知:P4(g)+6Cl2(g  4PCl3(g)ΔH=
4PCl3(g)ΔH=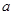 kJ·mol-1,P4(g)+10Cl2(g)
kJ·mol-1,P4(g)+10Cl2(g) 4PCl5(g) ΔH="b" kJ·mol-1,P4具有正四面体结构,PCl5中P-C1键的键能为c kJ·mol-1,PCl3中P-C1键的键能为1.2c kJ·mol-1。
4PCl5(g) ΔH="b" kJ·mol-1,P4具有正四面体结构,PCl5中P-C1键的键能为c kJ·mol-1,PCl3中P-C1键的键能为1.2c kJ·mol-1。
下列叙述正确的是
| A.P-P键的键能大于P-C1键的键能 |
B.可求Cl2(g)+PCl3(g) PCl5(s)的反应热ΔH PCl5(s)的反应热ΔH |
C.C1-C1键的键能为(b-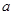 +5.6c)/4kJ·mol-1 +5.6c)/4kJ·mol-1 |
D.P-P键的键能为(5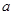 -3b+12c)/8kJ·mol-1 -3b+12c)/8kJ·mol-1 |
①C(s)+O2(g) CO2(g) ΔH=-393.5kJ/mol
CO2(g) ΔH=-393.5kJ/mol
②2H2(g)+O2(g) 2H2O(1) ΔH=-571.6kJ/mol
2H2O(1) ΔH=-571.6kJ/mol
现在0.2mol炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93kJ的热量,则混合物中C与H2物质的量之比为
| A.1︰1 | B.1︰2 | C.2︰3 | D.3︰2 |