下列叙述中正确的是(NA为阿伏加德罗常数)( )
| A.通常状况下将0.5mol HI气体和0.5 mol Cl2混合后,气体的分子数小于NA |
| B.同温同压下,相同体积的物质,其物质的量必相等 |
| C.5.3g Na2CO3固体含有的离子数为1.5NA |
| D.标准状况下,0.5 NA个Br2所占的体积约为11.2L |
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应为: Zn(s)+2MnO2(s)+H2O(l)= Zn(OH)2 (s)+Mn2O3(s),下列说法错误的是 ( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e- = Mn2O3(s)+2OH-( aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减少6.5g |
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是 ( )
| A |
B |
C |
D |
|
| 实 验 |
用CCl4提取 溴水中的Br2 |
除去乙醇中的苯酚 |
从KI和I2的固体 混合物中回收I2 |
配制100 mL 0.1000 mol·L-1 K2Cr2O7溶液 |
| 装 置 或 仪 器 |
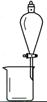 |
 |
 |
 |
一定条件下,体积为10L的密闭容器中,2molX和1molY进行反应:
2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
| A.以X浓度变化表示的反应速率为0.01mol/(L•S) |
| B.将容器体积变为20L,Z的平衡浓度变为原来的1/2 |
| C.若压强增大1倍,则物质Y的转化率增大1倍 |
| D.若降低温度,X的浓度增大,则该反应的△H>0 |
下列叙述不正确的是( )。
| A.向Mg(OH)2悬浊液中加少量NH4Cl固体,溶液变澄清 |
| B.向AgI在水中的平衡体系中加入Na2S溶液沉淀会转化为黑色 |
| C.用水洗涤BaSO4比用稀硫酸洗涤损失的沉淀要少 |
| D.MgCO3在水中加热可以转化为Mg(OH)2 |
下列溶液中微粒浓度关系一定正确的是 ()
| A.0.1 mol•L-1的硫酸铵溶液中:C(NH4+)>C(SO42-)>C(H+) |
| B.0.1 mol•L-1的硫化钠溶液中:C( OH-)=C(H+)+C(HS-)+C(H2S) |
| C.氨水与氯化铵的pH=7的混合溶液中:C(Cl-)>C(NH4+) |
| D.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合:C(OH-)= C(H+) |