一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时,已知数据如表所示:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的溶液的说法,比较合理的( )
A.向该混合溶液中加入少量铁粉即能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀
C.该混合溶液中c(SO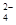 )∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
D.向该混合溶液中加入适量氯水,并调节pH为3~4,然后过滤,可得到纯净的CuSO4溶液
对于反应2A(g)+3B(g)=C(g)+5D(g),在某段时间内的平均反应速率为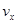 ,(x代表某反应物或生成物)之间的关系,正确的是()
,(x代表某反应物或生成物)之间的关系,正确的是()
A.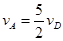 |
B.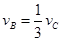 |
C.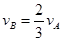 |
D.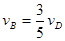 |
下列物质中,导电性能最差的是()
| A.熔融氢氧化钠 | B.石墨棒 | C.盐酸溶液 | D.固体氯化钠 |
下列各式中正确表示电解质电离的是( )
A.H3PO4 3H++PO43- 3H++PO43- |
B.HCO3-+H2O  H3O++CO32- H3O++CO32- |
C.CH3COONH4 CH3COO-+NH4+ CH3COO-+NH4+ |
D.NaHS==Na++H++S2- |
从以下事实中找出不能应用勒夏特列原理解释的是()
| A.温度过高对合成氨不利 |
| B.合成氨在高压下进行是有利的 |
| C.合成氨在高温下进行和加入催化剂都能使化学反应速率加快 |
| D.增大N2的浓度可提高平衡混合物中NH3的含量 |
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:①H2O(g)===H2O(l);ΔH=-Q1 kJ/mol;
②C2H5OH(g)===C2H5OH(l);ΔH=-Q2kJ/mol;
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g);ΔH=-Q3kJ/mol。
下列判断正确的是( )
| A.酒精的燃烧热为Q3kJ |
| B.若使23 g液体酒精完全燃烧,最后恢复到室温,释放出的热量为(1.5Q1-0.5Q2+0.5Q3)kJ |
| C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化 |
| D.从反应③可知1mol C2H5OH(g)的能量高于2CO2(g)和3H2O(g)的总能量 |