根据下列反应判断有关物质还原性由强到弱的顺序是( )
(1) H2SO3 + I2 + H2O ="==" 2HI + H2SO4
(2) 2FeCl3 + 2HI="==" 2FeCl2 + 2HCl + I2
(3) 3FeCl2 + 4HNO3="==" 2FeCl3 + NO↑+2H2O + Fe(NO3)3
| A.H2SO3 > I- > Fe2+ > NO | B.I- > Fe2+ > H2SO3 > NO |
| C.Fe2+ > I- > H2SO3 > NO | D.NO > Fe2+ > H2SO3 > I- |
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是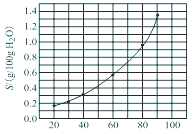
| A.溴酸银的溶解时放热过程 |
| B.温度升高时溴酸银溶解速度加快 |
| C.60 ℃时溴酸银的Ksp约等于6×10-4 |
| D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH = -lg[OH-])与pH的变化关系如图所示,则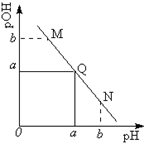
| A.M点所示溶液导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO-)﹥c(Na+) |
| C.M点和N点所示溶液中水的电离程度相同 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
一定温度下,下列溶液的离子浓度关系式正确的是
| A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1 |
| B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-) |
| D.pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ |
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
①HF(aq)+OH—(aq)=F—(aq)+H2O(l)△H=—67.7KJ·mol—1
②H+(aq)+OH—(aq)=H2O(l)△H=—57.3KJ·mol—1
在20mL0.1·molL—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
| A.氢氟酸的电离方程式及热效应可表示为HF(aq)=H+(aq) +F−(aq)△H=+10.4KJ·mol—1 |
| B.当V=20时,溶液中:c(OH—)=c(HF) +c(H+) |
| C.当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1 |
| D.当V>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+) |
250C时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图7 所示。下列有关溶液中离子浓度关系的叙述正确的是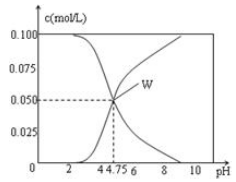
| A.pH="5." 5 的溶液中: c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| B.W 点所表示的溶液中: c(Na+)+c(H+)= c(CH3COOH)+c(OH-) |
| C.pH =" 3." 5 的溶液中: c(Na+) +c(H+) -c(OH-) +c(CH3COOH)=0.1mol·L-1 |
| D.向W 点所表示的1.0L 溶液中通入0.05mol HCl 气体(溶液体积变化可忽略):c(H+)= c(CH3COOH)+c(OH-) |