已知A、B、C、D、E、F六种元素的原子序数依次递增,前四种元素为短周期元素。A位于元素周期表s区,基态原子中电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每种能量不同的原子轨道中的电子数相同;C基态原子核外成对电子数为未成对电子数的3倍;D与C同主族;E、F位于同一周期和同一族,且E比F的核电荷数小2。
(1)E3+的核外有 个未成对电子,A2C2的电子式为 。
(2)F(BC)n的中心原子价电子数与配体提供电子总数之和为18,则n=________。
(3)B的一种氢化物分子中共有14个价电子,该分子中存在的共价键类型有 。(填代号)
A.非极性键 B.极性键 C. s—sσ键 D.s—pσ键
E.p—p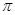 键 F.s—sp3σ键 G.sp3—sp3σ键 H.sp3—sp3 π键
键 F.s—sp3σ键 G.sp3—sp3σ键 H.sp3—sp3 π键
(4)A2D和A2C2的主要物理性质比较如下:
| |
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
| A2D |
187 |
202 |
2.6 |
| A2C2 |
272 |
423 |
以任意比互溶 |
A2D和A2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因
。
氢化阿托醛 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下: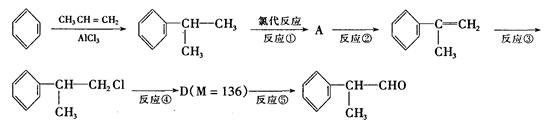
(1)在合成路线上②③的反应类型分别为②③ 。
(2)由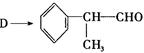 反应的化学方程式为。
反应的化学方程式为。
(3)1mol氢化阿托醛发生银镜反应最多可生成molAg。
(4)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为。D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有种。
有机物F、G是常见的塑料,可通过下图所示路线合成: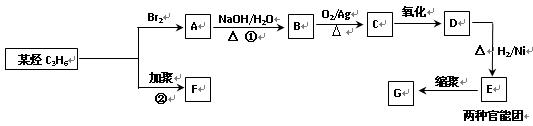
(1)高分子化合物G的结构简式是 。
(2)反应②的化学方程式是 。
(3)PBT(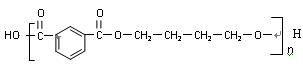 )是一种重要的工程塑料。
)是一种重要的工程塑料。
结合所学知识,请设计方案以CH2=CHCH=CH2 、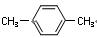 为原料合成PBT(请用反应流程图表示,并注明反应条件)。
为原料合成PBT(请用反应流程图表示,并注明反应条件)。
示例:由乙醇合成聚乙烯的反应流程图可表示为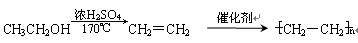
合成PBT的反应流程图为:
___________________________________________________________________________
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2 → O2
(1)写出该反应的化学方程式,并标出电子转移的方向和数目。
(2)该反应中的氧化剂是。
(3)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为。
两种气态烃A、B组成的混合气体完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图所示,则
(1)混合烃中n(C):n(H)=
(2)混合烃中一定有
(3)若相对分子质量A<B,试推断混合气体中A和B所有可能的组合及其物质的量之比,并将结果填入下表(有几组填几组,不一定填满)
| 组合编号 |
A的分子式 |
B的分子式 |
A和B的物质的量比 |
| ① |
|||
| ② |
|||
| ③ |
|||
| ④ |
|||
| ⑤ |
已知:
(1)傅瑞德尔一克拉福茨反应是在苯环上引入烷基的反应:
(2)
(3)烯烃与HX(X为原子或原子团)加成时,氢原子总是加在含氢较多的不饱和碳上,
即:
某同学给出了以乙烯、苯、食盐、水等为原料合成 的部分流程图:
的部分流程图:
试回答下列问题:
(1)反应物A可由食盐、水经一系列反应获得,则反应物A为(填化学式),写出制备A 的化学方程式
(2)反应物B为(填化学式)
(3)反应Ⅰ~ Ⅳ中,属于加成反应的是(填序号)
(4)中间产物C的属于芳香烃的同分异构体有种(不包括自身),其中苯环上的一氯代物有2种的是(写结构简式)
(5)下列关于中间产物D的说法不正确的是
| A.既能使酸性高锰酸钾溶液褪色,也能使溴水褪色 |
| B.既能溶于水,也能溶于苯中 |
| C.1mol 中间产物D最多可与4mol H2完全反应 |
| D.所有原子不可能共平面 |