化学式与俗名相符的是
| A.小苏打Na2CO3,苛性钠NaOH |
| B.芒硝Na2SO4·10H2O,消石灰Ca(OH)2 |
| C.苏打NaHCO3,石灰石CaCO3 |
| D.纯碱NaOH,食盐NaCl |
电浮选凝聚法处理酸性污水的工作原理如图。下列说法不正确的是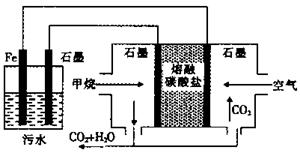
| A.铁电极的电极反应式为:Fe—2e—=Fe2+ |
| B.通入甲烷的石墨电极的电极反应式为:CH4+4CO32——8e—=5CO2+2H2O |
| C.为增强污水的导电能力,可向污水中加入适量工业用食盐 |
| D.若左池石墨电极产生44.8L(标况)气体,则消耗0.5 mol氧气 |
根据下列化学实验示意图及表中实验现象,能得出正确结论的是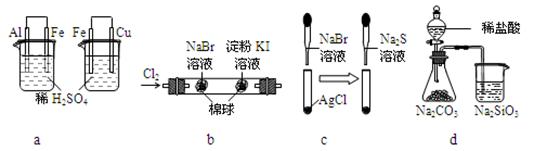
| 选项 |
实验 |
实验现象 |
结论 |
| A |
a |
左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
| B |
b |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
| C |
c |
白色固体先变为淡黄色,后变为黑色 |
溶解性:AgCl < AgBr< Ag2S |
| D |
d |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
如下图所示利用海洋资源可提取很多重要的化合原料。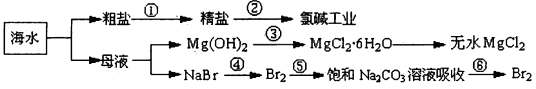
下列有关说法正确的是
| A.第①步中除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.第②步中工业上可采用石墨为阴极、铁为阳极,采用阳离子交换膜的电解装置 |
| C.第③步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| D.第④步中溴元素被氧化,第④⑤步的目的是富集溴元素 |
有NaCl和MgCl2组成的混合物153.5g,溶于水配成1L溶液,此溶液中Cl—的物质的量浓度为3mol/L,则原混合物中的MgCl2的质量为
| A.95g | B.47.5g | C.58.5g | D.117g |
海带中含碘元素,有人设计如下步骤来提取碘:①通足量氯气②将海带烧成灰,向灰中加水搅抖③加入CCl4振荡④过滤⑤用分液漏斗分液。合理的操作顺序
| A.②—④—①—③—⑤ | B.②—①—③—④—⑤ |
| C.①—③—⑤—②—④ | D.③—①—②—⑤—④ |